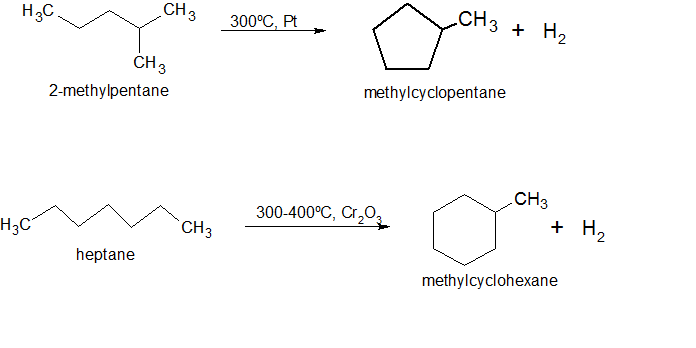
Алканы – химические и физические свойства
В данной статье мы рассмотрим такие соединения органической химии, как алканы – наиболее простейшие вещества органического характера. Подробно изучим все основные аспекты строения, различных свойств и узнаем о способах получения данных веществ и областях их применения.
- Алканы и их строение на примере метана
- Гомологический ряд и изомерия алканов
- Номенклатура или правила называния предельных углеводородов
- Физические свойства предельных соединений
- Химические свойства алканов
- Способы получения алканов
- Применение алканов
Алканы и их строение на примере метана
Алканами или предельными углеводородами являются такие углеводороды, в которых углеродные атомы соединены между собой одинарными связями, а все остальные их валентности затрачены на связывание с атомами водорода. Рассмотрим особенности строения алканов, взяв молекулу метана. Итак, метан является самым простым по строению алканом. Он имеет формулу CH4 и представляет собой легкий газ без цвета и запаха, малорастворимый в воде. Электронная плотность в молекуле этого вещества смещена к единственному углероду, из-за большей электроотрицательности данного элемента.

- Углерод находится в sp3-гибридизации – атом C обладает четырьмя гибридизованными орбиталями. Из-за перекрывания четырьмя гибридными орбиталями s-электронных облаков атомов водорода, появляются сигма-связи типа C-H. Вытянутая форма электронных облаков способствует более полному перекрыванию с электронными облаками других атомов. Выделяется больше энергии и образуются гораздо более прочные связи.
- Валентный угол = 109 градусов 28 минут.
- Форма молекулы (рис.1) – молекула метана представляет собой обыкновенный тетраэдр, в центре которого находится углерод, соединенный четырьмя простыми связями с атомами водорода. Водороды располагаются при вершинах фигуры.
- Длина простой углерод-углеродной сигма-связи = 0,154 нм.
Важно! 1874 год – химики Вант-Гофф и Жан-Лебель выдвинули теорию о подобном тетраэдрическом строении метана. Их теория была подтверждена после того, как американский ученый Лайнус Полинг выдвинул идею гибридизации.
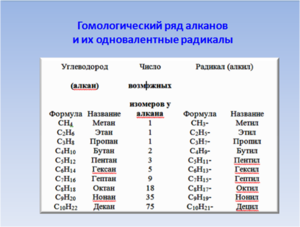
Гомологический ряд и изомерия алканов
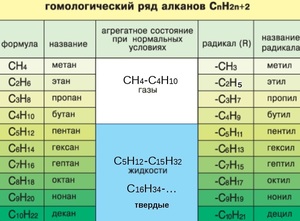
- метан – CH4
- этан – C2 H6
- пропан – C3 H8
- бутан – C4 H10
- пентан – C 5 H 12
- гексан – C 6 H 14
- гептан – C 7 H16
- октан – C 8 H 18
- нонан – C 9 H 20
- декан – C 10 H 22

Номенклатура или правила называния предельных углеводородов
- Найти и отметить наиболее длинную цепь атомов углерода.
- Начать нумерацию с той стороны, к которой ближе разветвленность молекулы.
- Основой названия будет являться углеводород с тем же числом углеродных атомов, что и в самой длинной цепочке.
- Перед основой назвать все заместители с обязательным указанием атомов C, к которым они присоединены.
- При написании названия предельного соединения цифры отделить друг от друга запятыми, а цифры от слов – дефисами.
Физические свойства предельных соединений
- Вещества, которые начинаются с метана и заканчиваются бутаном – это газы без цвета и запаха.
- Соединения с пентана до углеводорода, имеющего семнадцать углеродных атомов, являются жидкостями без всякого цвета с характерным бензиновым запахом. Могут с легкостью смешиваться друг с другом.
- Все остальные предельные соединения имеют твердое агрегатное состояние, белый цвет и жирную оболочку.
Важно! Помните, что с увеличением молекулярной массы алкана увеличиваются температуры кипения, плавления, а также плотность молекул.
Химические свойства алканов
При изучении любых органических веществ следует обратить особое внимание на их химические свойства. Они являются показателем химической активности и реакционной способности соединения. Алканы не реагируют с концентрированными серной и азотной кислотами. Они не обесцвечивают окраску растворов окислителей, таких как перманганата калия или бромной воды.
Реакции замещения
Галогенирование
Алканы взаимодействуют главным образом с бромом и хлором. При взаимодействии метана и хлора на свету получим хлорметан (CH3 Cl) и хлороводород. Галогенирование проходит в четыре стадии с поочередным замещением атомов водорода в молекуле метана. На второй, третьей и четвертой стадиях свет уже не является обязательным условием реакции. На второй стадии галогенирования выделяется дихлорметан (CH2 Cl2 ), на третьей – хлороформ (CHCl3 ), на четвертой – четыреххлористый углерод (CCl4 ).

Рис. 3. Физические свойства алканов Отметим, что данные реакции идут по цепному свободнорадикальному механизму, который состоит из следующих этапов: инициирование цепи, развитие цепи, обрыв цепи или рекомбинация. Возьмем другой случай: пропан взаимодействует с бромом на свету. В данной ситуации один атом брома будет присоединяться к вторичному атому углерода. В результате получим 2-бромпропан и бромоводород.
После того, как все атомы водорода вторичного углерода будут замещены на атомы брома, весь последующий бром может присоединяться к первичным углеродам.
Нитрование (реакция Коновалова)
В данном типе реакций возьмем пропан, который взаимодействует с разбавленной азотной кислотой, находящейся в парах. При температуре в 140 градусов образуется соединение под названием 2-нитропропан и вода соответственно.
Сульфирование
Пропан реагирует с концентрированной, дымящейся серной кислотой при термовоздействии. Принцип действия аналогичен реакции нитрования. В данном случае один атом водорода при вторичном углероде замещается на сульфо-группу. Выделится вода и пропан-2-сульфокислота.
Дегидрирование
От алканов отщепляется два атома водорода. Процесс идет при катализаторе или платины при температуре. На выходе получаем алкен и водород.
Реакции окисления
- Полное сгорание – алканы горят с образованием CO2 и H2 O. При этом идет выделение энергии до 900 кДж.
- Неполное сгорание – так сгорает, например, гексан. Он взаимодействует с кислородом и образует CO2 , H 2 O и чистый углерод.
- Окисление в мягких условиях – метан взаимодействует с кислородом в присутствии катализатора и при температуре 200 градусов. В ходе данного взаимодействия могут получиться следующие вещества: метанол (CH3OH), метаналь (CH2 O), муравьиная кислота (CH2O2).
Реакции изомеризации
Довольно простой тип реакций алканов. В ходе изомеризации из алканов можно получать их изомеры в присутствии катализатора хлорида алюминия и температуры. Например, из нормального бутана с легкостью получаем метилпропан.
Реакции пиролиза
- Этан распадается на углерод и водород;
- Метан разлагается на водород и ацетилен, который впоследствии образует углерод и водород.
Крекинг
Данные реакции идут при термическом воздействии и без доступа воздуха. Алкан буквально делится на две части. Из одной в другую переходит один водород. В итоге мы получаем нормальный алкен и нормальный алкан.
Дегидроциклизация
Реакции, в которых от алканов отщепляется водород, и появляется ароматическая связь. Взаимодействие идет при действии катализаторов платиновой группы и температуры. Из гексана мы получаем данным способом бензол, а из гептана – толуол. Данное взаимодействие, кстати, является промышленным способом получения бензола. Теперь вы знаете обо всех химических способностях алканов. Осталось их тщательно проработать и выучить.
Алканы: строение и химические свойства, получение насыщенных углеводородов
Трудно себе представить наш быт без голубых язычков огня кухонной плиты или газовой зажигалки. В этих устройствах сгорают углеводороды одного и того же класса — алканы. Различие лишь в том, что бытовой газ представляет собой главным образом метан СН4, а в резервуаре зажигалки находятся под давлением сжиженные газы пропан С3Н8 и бутан С4Н10.
Углеводороды, молекулы которых не содержат кратных связей, называют предельными или насыщенными.
Своё название предельные углеводороды получили потому, что все валентности углеродных атомов в их молекулах насыщены атомами водорода до предела.
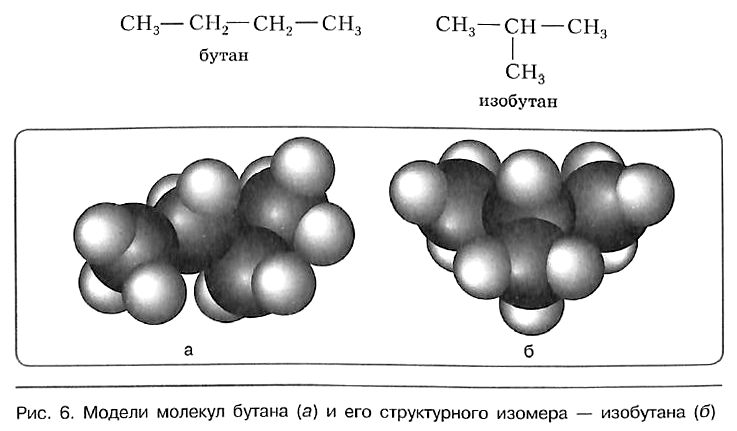
Сокращённая структурная формула пропана СН3—СН2—СН3. Для бутана возможно написание двух структурных формул: в одной углеродная цепь имеет линейное, а в другой — разветвлённое строение:
Свойства бутана и изобутана различны: бутан имеет более низкие температуры кипения и плавления. По отношению друг к другу бутан и изобутан являются изомерами, различающимися строением углеродной цепи. Изомерия углеродной цепи — вариант структурной изомерии.
| Алканы — это предельные углеводороды с общей формулой С n Н2 n +2, в молекулах которых все атомы соединены простыми (одинарными) связями. |

В молекулах алканов углеродные цепи открытые, т. е. незамкнутые. Но предельными могут быть и углеводороды, имеющие замкнутую углеродную цепь. Этот класс соединений называют циклоалканами. Некоторые циклоалканы, например циклогексан С6Н12, входят в состав нефти.
Простейший представитель алканов — метан СН4. Именно это соединение является родоначальником гомологического ряда алканов.
| Ряд расположенных в порядке возрастания относительных молекулярных масс веществ, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп СН2 (гомологическую разность), называют гомологическим рядом. Вещества такого ряда называют гомологами. |
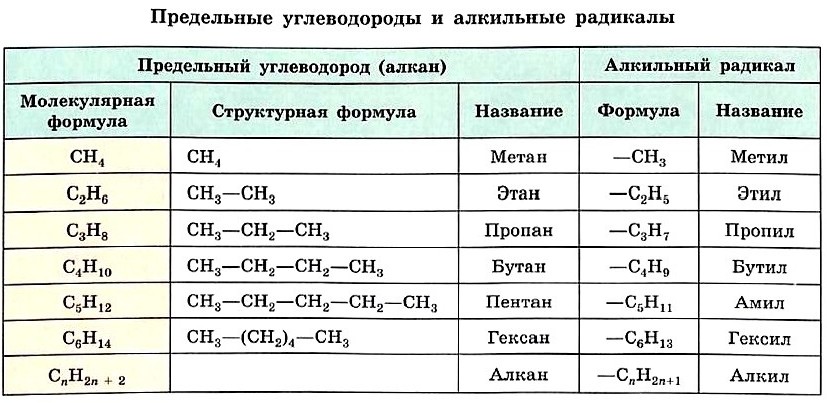
Формулу каждого последующего члена гомологического ряда легко получить из формулы предыдущего, заменив один атом водорода в молекуле на группу СН3. Так, второй гомолог ряда алканов — этан — имеет формулу СН3—СН3. Формулы и названия первых шести представителей алканов с неразветвлённой цепью атомов углерода приведены в таблице.
Если от молекулы алкана мысленно отщепить один атом водорода, мы получим частицу со свободной валентностью у атома углерода — радикал.
Название радикала, соответствующего предельному углеводороду, т. е. алкильного радикала, строится так: суффикс -ан заменяют на -ил, а состав будет подчиняться общей формуле С n Н2 n +1. Формулы и названия алкильных радикалов, приведённые в таблице, нужно запомнить, чтобы уметь называть органические вещества с разветвлённой углеродной цепью.

(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Номенклатура алканов
Для построения названий органических веществ, в частности предельных углеводородов, используют свод правил — номенклатуру. В соответствии с так называемой международной, или систематической, номенклатурой при составлении названий алканов руководствуются следующими правилами:
- 1) выбирают в молекуле самую длинную цепь атомов углерода;
- 2) нумеруют атомы углерода в цепи с того конца, к которому ближе разветвление;
- 3) записывают основу названия вещества — название углеводорода с тем же числом углеродных атомов, что и в пронумерованной цепи;
- 4) перед основой названия перечисляют все заместители основной цепи с указанием номеров атомов углерода, при которых они стоят. Если одинаковых заместителей несколько, перед их названиями ставят приставки ди-, три-, тетра-,
- 5) все цифры друг от друга отделяют запятыми, буквы от цифр — дефисом. Если при одном углеродном атоме имеется не один, а два заместителя, его цифра повторяется в названии дважды;
- 6) перед названием предельного углеводорода нормального (неразветвлённого) строения ставят букву н-.
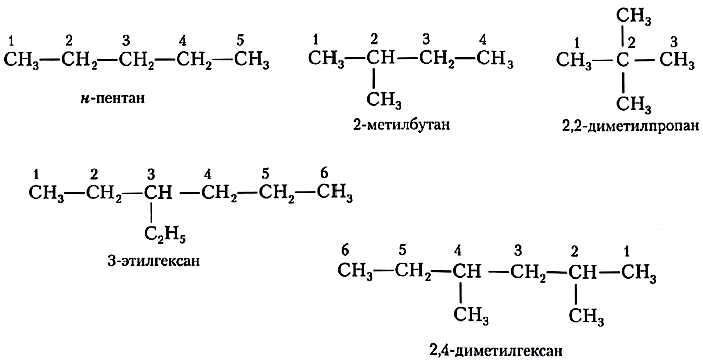
Проиллюстрируем эти правила примерами названий алканов.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.

Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
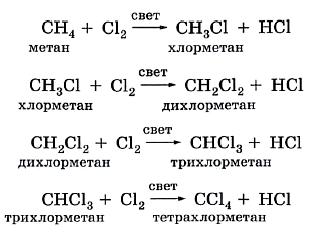
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов:

Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.

Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.

Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
| Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования . |

При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речь в следующем параграфе.
Таблица «Предельные углеводороды
(алканы, парафины)»

Конспект урока по химии «Предельные углеводороды. Алканы«. В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Алканы: строение и химические свойства, получение насыщенных углеводородов
II. Химические свойства алканов
1. Реакции замещения
а) Галогенирование
При действии света – hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
В реакции образуются вещества галогеналканы RГ или С n H 2n+1 Г
(Г – это галогены F, Cl, Br, I)
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 стадия)
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 стадия)
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе ( – СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C.

б) Нитрование (реакция М.И. Коновалова , он провёл её впервые в 1888 г)
2. Реакции отщепления (дегидрирование)
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
3. Реакции перегруппировки (изомеризация)
4. Реакции горения (горят светлым не коптящим пламенем)
Помните! Смесь метана с воздухом и кислородом взрывоопасна
5. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С и Н2:
в) Конверсия метана с образованием синтез – газа (СО + Н2)
III. Получение алканов
1. Получение в лаборатории
1. Гидролиз карбида алюминия (получение метана):
2. Реакция Вюрца (взаимодействие натрия с галогенпроизводными алканов):
(R- это радикал; Г- это галоген)
3. Термическое декарбоксилирование солей карбоновых кислот в присутствии щелочей:
(ацетат натрия+ едкий натр=(метан+карбонат натрия)
этилат натрия этан
4. Каталитическое гидрирование алкенов и алкинов:
5. Электролиз растворов солей карбоновых кислот – реакция КОЛЬБЕ
Пример. Электролиз водного раствора ацетата натрия
Катод (-): H2O , Na + – Процесс восстановления: 2H 2 O + 2ē → H 2 ↑ + 2OH –
Анод (+): H 2 O, CH3COO – (анионы органических кислот активнее воды) – Процесс окисления:
2H2O + 2CH3COONa эл . ток = H2 + 2NaHCO3 + C2H6
2. Получение в промышленности
1. Из природного и попутного нефтяного газа
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье – нефть и сопутствующие ей нефтяные газы. Природный газ на 95 процентов состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов.
Метан называют ещё и болотным; рудничным газом.
Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее разгонке (перегонке, дистилляции) отбирая последовательно все более и более высококипящие фракции получают:
бензины – т. кип. от 40 до 180 С, (содержит углеводороды С5-С10), состоит более, чем из 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов, алкенов и ароматических углеводородов;
легкий газойль (дизельное топливо) 230-305 С (С13-С17);
тяжелый газойль и легкий дистиллят смазочного масла 305-405 С (С18-С25);
смазочные масла 405-515 С (С26-С38).
Остаток после перегонки нефти называется асфальтом или битумом.
2. Синтезом из водяного газа:
3. Синтезом из простых веществ:
IV. Применение
1. Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
2. Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит.
3. Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках.
4. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров.
5. Метан используется для производства шин и краски.
6. Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
Предельные углеводороды.Номенклатура алканов,изомерия,получение,физические свойства и химические свойства,применение.
Углеводороды – это простейшие органические соединения, которые состоят из двух элементов – углерода, водорода.
Алканы – это ациклические углеводороды, содержащие только простые связи С-С. Их характеристики: 1) общая формула СnH2n+2; 2) все атомы углерода находятся в состоянии sp 3 -гибридизации, угол между связями C–C 109°28′, длина связи равна 0,154 нм; 3) имеют прочные ковалентные σ-связи; 4) характерные реакции – замещения, полного и частичного окисления.
Гомологический рядалканов представлен в таблице 4.
Изомерия:1) углеродного скелета; 2) оптическая.
Физические свойства.При обычных условиях СН4 . С4Н10 – газы, С5Н12 . С15Н32 – жидкости, с С16Н34 – твердые вещества. С ростом относительной молекулярной массы, возрастают температуры кипения и температуры плавления. Алканы – бесцветные вещества, легче воды, плохо растворяются в воде.
Химические свойства. Алканы содержат σ-связи С-Н и С-С, для которых характерны высокая прочность, малая полярность, низкая поляризуемость. Алканы обладают низкой реакционной способностью.
I. Реакции замещения (SR) осуществляются по свободно-радикальному (цепному) механизму.
1. Галогенирование (образуются галогенпроизводные УВ). Реакцияпротекает при УФ-облучении или высокой температуре:

метан хлор- дихлор- трихлор- тетра-
метан метан метан хлорметан
2. Нитрование (образуются нитросоединения):
– в жидкой фазе (М.И. Коновалов). Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:

– в газовой фазе. При температуре 400–500 0 С образуется смесь изомерных нитроалканов, а также нитроалканы с меньшим числом атомов углерода в результате разрыва связей С–С:

3. Сульфирование. Сульфирование алканов происходит при действии очень концентрированной H2SО4 при небольшом нагревании.

II. Реакции окисления.
1. Полное окисление (избыток O2):

2. Неполное окисление (недостаток О2):


3. Неполное каталитическое окисление в присутствии О2. В зависимости от природы катализатора и условий проведения реакции могут образоваться альдегиды RCOH, кетоны R–СО– R, спирты ROH, карбоновые кислоты RCOOH.
III. Термические превращения алканов.
1. Термический крекинг (пиролиз) осуществляется при температуре 450—700 0 С:

2.Дегидрированиеосуществляется в присутствии катализаторов при повышенных температурах.

Получение алканов. Основные природные источники алканов – нефть и природный газ. Различные фракции содержат алканы от С5Н12 до С30Н62. Природный газ состоит из метана (95 %) с примесью этана и пропана.
Получение и химические свойства алканов
Рассмотрим получение и химические свойства алканов. В промышленности основным исходным сырьем для получения алканов служат такие природные источники как нефть и природный газ. Нефть – сложный природный объект, основную массу которого составляют углеводороды (УВ) трех гомологических рядов – алканы, циклоалканы и арены, однако наиболее широко представлены углеводороды смешанного гибридного строения. В составе различных фракций нефти содержатся алканы с числом углеродных атомов от 5 до 30. На 95% природный газ состоит из метана, остальные 5% — примесью этана и пропана.
Алканы выделяют из сырья путем фракционной перегонки, основанной на разности температур кипения. Однако выделение чистых индивидуальных алканов является сложным процессом, поэтому чаще всего получают их смеси. Другим способом их получения является крекинг — термическое разложение углеводородов, в результате которого в углеводородной цепи соединений с более высокой молекулярной массой происходит разрыв углерод-углеродной связи с образованием соединений с более низкой молекулярной массой.
Различают термический крекинг и каталитический крекинг.
Термический крекинг был открыт русским инженером В.Г. Шуховым в 1891 г. Термический крекинг проводят при температуре 450–700 o С. При этом происходит разрыва С–С связей высококипящих алканов с образованием более низкокипящих алканов и алкенов:
При температуре более 1000°С происходит разрыв как С–С связей, так и более прочных С–Н связей.
Каталитический крекинг осуществляется при температуре 500°С, атмосферном давлении в присутствии катализаторов (чаще всего оксидов алюминия и кремния). В этом случае разрыв связей молекул сопровождается реакциями изомеризации и дегидрирования.
Синтетические методы получения алканов
1.Гидрирование ненасыщенных углеводородов.
Реакцию осуществляют в присутствии катализаторов (Ni, Pd) при нагревании:
2.Дегалогенирование моногалогенпроизводных алканов.
В присутствии металлического натрия нагревание моногалогензамещенных алканов приводит к образованию алканов с удвоенным числом атомов углерода (реакция Вюрца):
3.Сплавление безводных солей карбоновых кислот с щелочами. При получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот (реакция Дюма):
4.Получение смеси алканов из синтез-газа (СО + Н2):
5.Электролиз раствора солей карбоновых кислот (синтез Кольбе).
При электролизе солей карбоновых кислот на аноде выделятся соответствующий алкан и углекислый газ, на катоде — водород и щелочь
Получение метана
1. Действие на раскаленную медь смеси сероводорода и сероуглерода:
2. Нагревание до 1200 градусов смеси водорода и углерода (а в присутствии никелевого катализатора до 475 градусов):
Та же самая реакция протекает в горящей в атмосфере водорода электрической дуге.
3. Взаимодействие карбида алюминия с водой:
4. Нагревание смеси щелочи и ацетата натрия:
5. Взаимодействие водорода и оксида углерода (II):
Химические свойства алканов
Алканы ввиду насыщенности связей при нормальных условиях являются инертными веществами (их еще называют «химические мертвецы»). Они не способны вступать в реакции восстановления, при комнатной температуре не окисляются даже под действием таких сильных окислителей как К2Cr2O7, KMnO4 и т.п. Однако в определенных условиях они могут вступать в реакции окисления (горения), дегидрирования, дегидроциклизации, изомеризации, разложения (крекинг), замещения.
1.Реакция дегидрирования (протекает при повышенной температуре в присутствии катализаторов Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO):
2СН4 → CH≡CH+ H2 (катализатор — С, 1500°С)
2.Реакция дегидроциклизации (протекает при повышенной температуре в присутствии катализаторов):
3.Реакция изомеризации (протекает при повышенной температуре в присутствии катализатора):
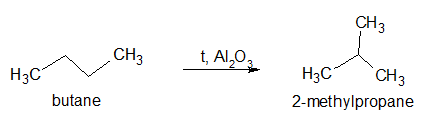
4.Крекинг (нагрев до высоких температур без доступа воздуха):
5.Окисление:
Неполное окисление алканов используют для получения карбоновых кислот, кетонов, альдегидов, спиртов:
бутан уксусная кислота
Действие кислорода воздуха в присутствии солей марганца на алканы с числом атомов углерода в цепи более 25 приводит к образованию смеси карбоновых кислот, среднее число атомов углерода в цепи которых составляет 12-18.
Полное окисление алканов (горение) –это экзотермическая реакция, которая сопровождается разрывом всех С-С и С-Н связей:
Низшие алканы (метан, этан, пропан, бутан) – легко воспламеняются, увеличение углеродной цепи алканов ведет к затруднению их горения, что объясняется недостатком кислорода воздуха, необходимого для полного окисления всего углерода. При этом происходит горение с образованием копоти, угарного газа.
6.Реакция образования «синтез-газа»:
СН4 + H2O → CO + 3H2 (катализатор — Ni, 800°С)
7. Реакция замещения (SR)
Замещение атома водорода происходит по радикальному механизму. Вначале преимущественно замещается третичный атом углерода, затем вторичный и первичный.
- Реакция галогенирования алканов возможна только при действии света или высокой температуры. При этом образуются галогеналканы:
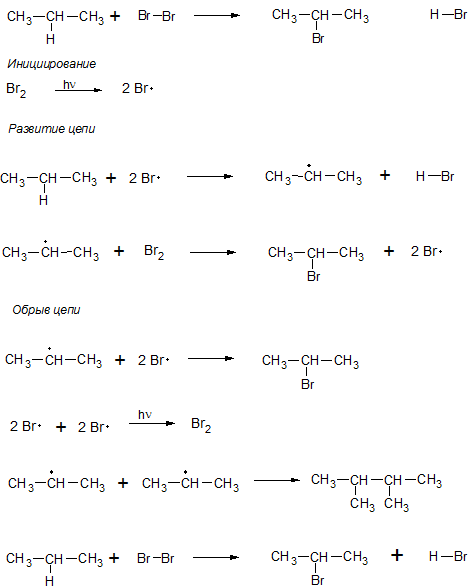
Реакция продолжается до тех пор, пока не израсходуется один из реагентов. При большом количестве галогена в результате реакции образуется смесь продуктов замещения 2-х, 3-х и т.д. атомов водорода
Алканы — предельные углеводороды, их химические свойства
Углеводороды представляют собой простейшие органические соединения. Их составляют углерод и водород. Соединения этих двух элементов называются предельными углеводородами или алканами. Их состав выражается общей для алканов формулой CnH2n+2, где n — количество атомов углерода.
Алканы — международное наименование данных соединений. Также эти соединения называют парафинами и насыщенными углеводородами. Связь в молекулах алканов простая (или одинарная). Остальные валентности насыщены атомами водорода. Все алканы насыщены водородом до предела, его атомы находятся в состоянии sp3-гибридизации .
Гомологический ряд предельных углеводородов

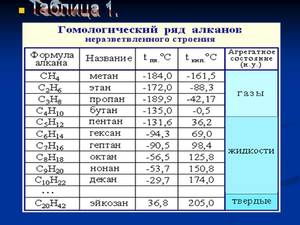
Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан — C2H6, пропан C3H8, бутан — C4H10.
С пятого алкана в гомологическом ряду названия соединений образуются следующим образом: греческое число, указывающее число атомов углеводорода в молекуле + окончание -ан. Так, по-гречески число 5 — пэндэ, соответственно за бутаном идет пентан — C5H12. Далее — гексан C6H14. гептан — C7H16, октан — C8H18, нонан — C9H20, декан — C10H22 и т. д.
Физические свойства алканов заметно изменяются в гомологическом ряду: увеличивается температура плавления, кипения, увеличивается плотность. Метан, этан, пропан, бутан при обычных условиях, т. е. при температуре равной примерно 22 градуса тепла по Цельсию, являются газами, с пентана по гексадекан включительно — жидкостями, с гептадекана — твердыми веществами. Начиная с бутана, у алканов есть изомеры.
Это интересно: нуклеотид это что такое? Его строение, масса, длина и последовательность.
Существуют таблицы, отражающие изменения в гомологическом ряду алканов, которые наглядно отражают их физические свойства.
Номенклатура насыщенных углеводородов, их производные
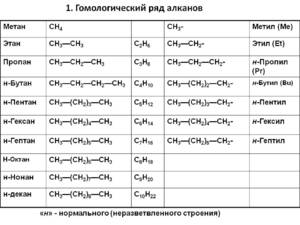
Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана — этил, из пропана — пропил и т. д.
Радикалы также образуются и неорганическими соединениям. Например, отняв у азотной кислоты гидроксильную группу ОН, можно получить одновалентный радикал -NO2, который называется нитрогруппой.
При отрыве от молекулы алкана двух атомов водорода образуется двухвалентные радикалы, названия которых также образуются из названия соответствующих углеводородов, но окончание меняется на:
- илиен, в том случае, если атомы водорода оторваны от одного атома углерода,
- илен, в том случае, если от двух атомы водорода оторваны от двух соседних атомов углерода.
Алканы: химические свойства
Рассмотрим реакции, характерные для алканов. Всем алканам присущи общие химические свойства. Данные вещества являются малоактивными.
Все известные реакции с участием углеводородов подразделяются на два вида:
- разрыв связи С-Н (примером может служить реакция замещения);
- разрыв связи С-С (крекинг, образование отдельных частей).
Очень активны в момент образования радикалы. Сами по себе они существуют доли секунды. Радикалы легко вступают в реакции между собой. Их неспаренные электроны образуют новую ковалентную связь. Пример: CH3 + CH3 → C2H6
Радикалы легко вступают в реакции с молекулами органических веществ. Они либо присоединяются к ним, либо отрывают от них атом с неспаренным электроном, в результате чего появляются новые радикалы, которые, в свою очередь, могут вступать в реакции с другими молекулами. При такой цепной реакции получаются макромолекулы, которые перестают расти только тогда, когда оборвется цепь (пример: соединение двух радикалов)
Реакции свободных радикалов объясняют многие важные химические процессы, такие как:
- Взрывы;
- Окисления;
- Крекинг нефти;
- Полимеризацию непредельных соединений.
Подробно можно рассмотреть химические свойства насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации , и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Алканы могут гореть. Горит метан синеватым бледным пламенем. При этом результатом реакции будут оксид углерода и вода. При смешивании с воздухом, а также в смеси с кислородом, особенно если соотношение объемов будет 1:2, данные углеводород образует взрывчатые смеси, из-за чего он крайне опасен для применения в быту и шахтах. Если метан сгорает не полностью, то образуется сажа. В промышленности ее таким образом и получают.
Из метана получают формальдегид и метиловый спирт путем его окисления в присутствии катализаторов. Если же метан сильно нагреть, то он распадается по формуле CH4 → C + 2H2
Распад метана можно осуществить до промежуточного продукта в специально оборудованных печах. Промежуточным продуктом будет ацетилен. Формула реакции 2CH4 → C2H2 + 3H2. Выделение ацетилена из метана сокращает расходы производства почти в два раза.
Также из метана получают водород, производя конверсию метана с водяным паром. Характерными для метана являются реакции замещения. Так, при обычной температуре, на свету галогены (Cl, Br) по стадиям вытесняют водород из молекулы метана. Таким образом образуются вещества, называемые галогенопроизводными. Атомы хлора, замещая в молекуле углеводорода атомы водорода, образуют смесь разных соединений.
В такой смеси присутствуют хлорметан (CH3 Cl или хлористый метил), дихлорметан (CH2Cl2или хлористый метилен), трихлорметан (CHCl3 или хлороформ), тетрахлорметан (CCl4 или четыреххлористый углерод).
Любое из этих соединений может быть выделено из смеси. В производстве важное значение отводится хлороформу и тетрахлорметану, в силу того, что они являются растворителями органических соединений (жиров, смол, каучука). Галогенопроизводные метана образуются по цепному свободнорадикальному механизму.
Свет воздействует на молекулы хлора, вследствие чего они распадаются на неорганические радикалы, которые отрывают атом водорода с одним электроном от молекулы метана. При этом образуется HCl и метил. Метил реагирует с молекулой хлора, в результате чего получается галогенопроизводное и радикал хлора. Далее радикал хлора продолжает цепную реакцию.
При обычной температуре метан обладает достаточной стойкостью к щелочам, кислотам, многим окислителям. Исключение — азотная кислота. В реакции с ней образуется нитрометан и вода.
Реакции присоединения для метана не характерны, т. к. все валентности в его молекуле насыщены.
Реакции, в которых участвуют углеводороды могут проходить не только с расщеплением связи С-Н , но и с разрывом связи С-С . Такие превращения происходят при наличии высоких температур и катализаторов. К таким реакциям относятся дегидрогенизация и крекинг.
Из насыщенных углеводородов путем окисления получают кислоты — уксусную (из бутана), жирные кислоты (из парафина).
Получение метана
В природе метан распространен достаточно широко. Он — главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот. Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно. Они используются как топливо, на различных производствах, в медицине и технике.
В условиях лаборатории данный газ выделяют при нагревании смеси ацетат натрия + гидроксид натрия, а также реакцией карбида алюминия и воды. Также метан получают из простых веществ. Для этого обязательными условиями являются нагрев и катализатор. Промышленное значение имеет получение метана синтезом на основе водяного пара.
Метан и его гомологи могут быть получены при прокаливании солей соответствующих органических кислот с щелочами. Еще одним способом получения алканов является реакция Вюрца, при которой нагреваются моногалогенопроизводные с металлическим натрием. Онтология читайте у нас на сайте.





