Строение белков – особенности, функции, биологическая роль
Строение белков занимает огромное по важности место как в биологии, так и в других естественных науках. В этой статье подробно разберем строение белков, доходя до последней четвертичной структуры. В этом вопросе также стоит учитывать основные свойства этих биополимеров, которые исходят из особенностей их строения. Из расположения различных структур в молекулах белков следуют их функции и биологическая роль в клетках.
- Белки – что это такое
- Составляющие белков
- Структуры белков
- Свойства белков
- Классификация белков
- Функции белков
Белки – что это такое
Все мы знаем, что данные соединения очень важны в нашей жизни. Многие ученые говорили и говорят о том, что без белков нет жизни. Они правы. Эти биополимеры крепко связаны с наследственной информацией и жизненной энергией. И все-таки дадим определение данным компонентам всех живых систем. Белки – нерегулярные, то есть непериодические биополимеры, мономерами которых являются 20 аминокислот. В их состав входят: углерод, водород, кислород, азот, иногда сера. Биополимерами называются крупные молекулы, состоящие из более простых молекул – мономеров. Как вы поняли из определения, белки являются крупными молекулами или макромолекулами и высокомолекулярными соединениями. Например, гемоглобин имеет молярную массу около 64 тыс. Молярная масса альфа-амилазы почти доходит до 100 тыс. А если брать и белки, составляющие оболочки вирусов – капсиды, то они содержат до 40 млн частиц.
Помните, что растения сами синтезируют все мономеры белков, а животные только их малую группу. Животные получают все остальные аминокислоты из органических соединений при питании.

Составляющие белков
- Пептидные – основные связи в белках, ковалентные, прочные;
- Ионные – образуются посредством анионов COO – и катионов NH3 + ;
- Водородные – слабые, но когда их возникает много, то цепочки становятся прочнее;
- Связи вида S-S – образуются посредством дисульфидных мостиков.

Структуры белков
Каждый белок в природе состоит из определенного количества структур, которые обусловливают сложность его строения. Они формируются в каналах эндоплазматической сети. С этими структурами сильно связаны и основные свойства белков – денатурация и ренатурация, которые мы рассмотрим позже.
Первичная структура
Данная структура определяет количество аминокислот в цепи пептидов. В молекуле возникают пептидные связи (рис.1). То есть эта структура представляет собой последовательность различных аминокислот, соединенных друг с другом пептидными связями.
Важно! В период с 1944 года по 1954 год биохимиком Сенгером в Великобритании был открыт инсулин, имеющий в своем составе 51 аминокислоту и первичную структуру. Также было тщательно изучено его строение.
Вторичная структура
Представляет собой альфа-спираль, которая прошита многочисленными водородными связями (рис.2). Еще данная структура может представлять собой бета-слой. Бета-слой (рис.3) – складчатая структура, состоящая из ряда параллельных полипептидных цепей, соединенных водородными связями. Является более прочным, чем альфа-спираль.

Третичная структура
Здесь полипептидная цепь компактно уложена в глобулу (рис.4). В глобулу могут входить ионные, водородные, дисульфидные связи. Между радикалами могут возникать гидрофобные и гидрофильные взаимодействия. Сюда же входят различные ферменты и антитела с глобулярным строением.

Четвертичная структура
Пожалуй, является наиболее сложной из всех. В ней несколько полипептидных цепей удерживаются в молекуле гидрофобными взаимодействиями и ионными связями (рис.5). Четыре глобулы соединены воедино. Данное строение имеет гемоглобин, чрезвычайно важный для человеческого организма. Теперь, после изучения основного строения белков, перейдем к краткому рассмотрению свойств этих биополимеров, которые вытекают из наличия всех указанных выше структур.
Органические вещества клетки: белки
Белки – это биологические гетерополимеры; синтезируются в живых организмах и выполняют в них важнейшие функции. В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.

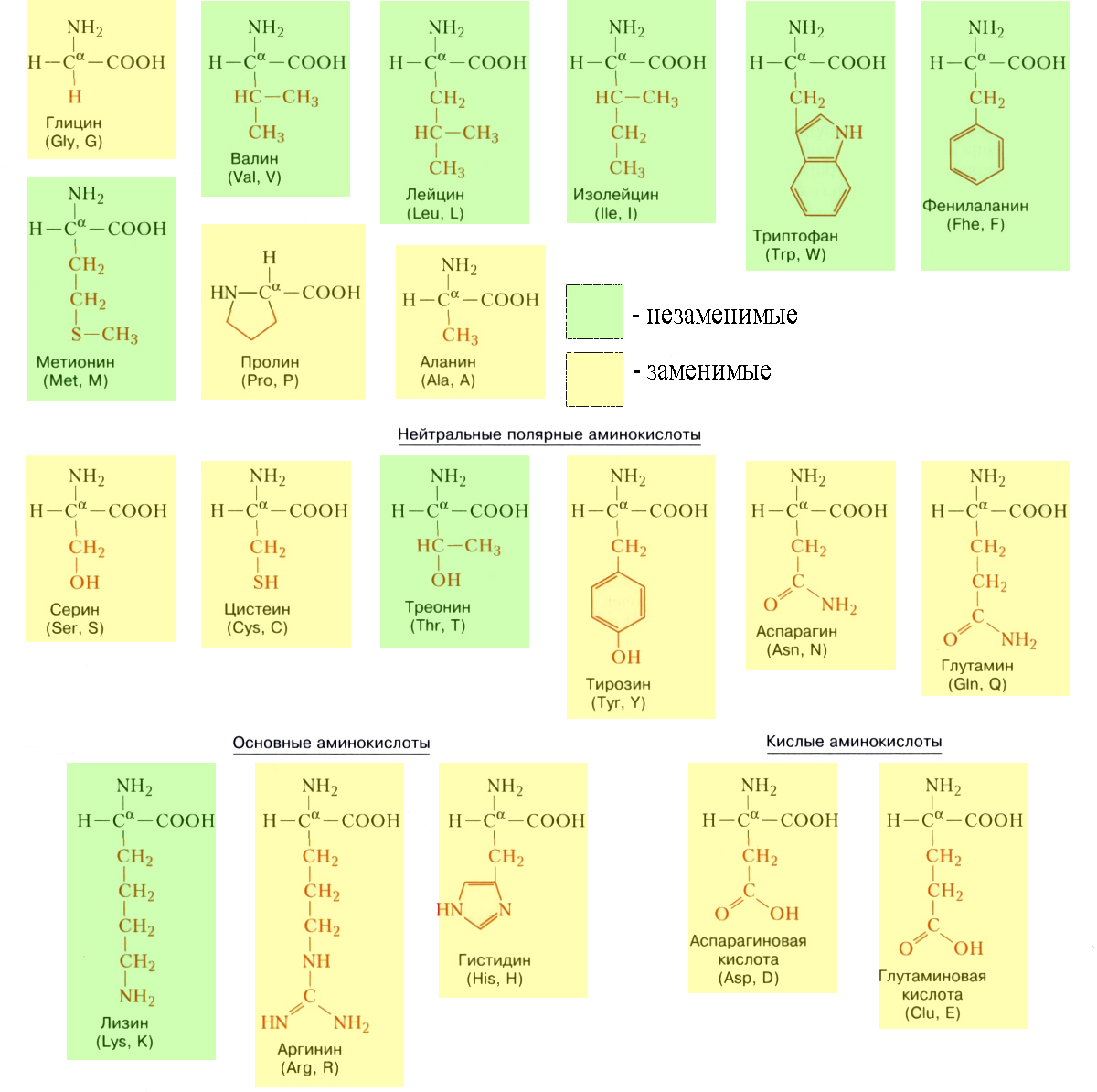
Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу NH2 и карбоксильную группу СООН и изменяемую часть – радикал (по которому и различаются аминокислоты).
Аминокислоты обладают свойствами и кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут (отсюда – заменимые и незаменимые аминокислоты). Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Незаменимых аминокислот восемь: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин . Если они не поступают в организм, происходит значительное нарушение его функций. Запомнить незаменимые аминокислоты можно так:

Таблица аминокислот
Структура белковой молекулы – это ее аминокислотный состав, последовательность мономеров (аминокислот) и степень скрученности молекулы.
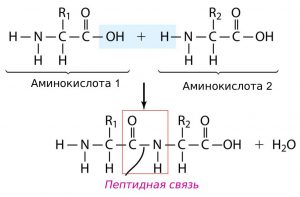
1. Последовательность аминокислот в молекуле белка образует его первичную структуру . Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
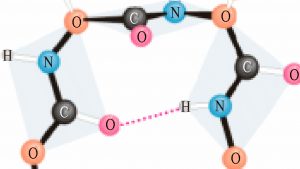
2. Сначала длинная молекула белка сворачивается и приобретает вид спирали. При этом образуется вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие витки спирали в свернутом положении.
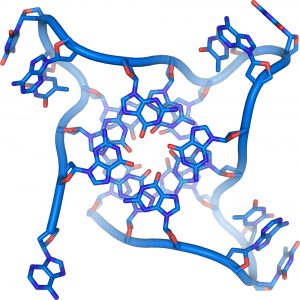
3. Далее молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями, обеспечивающими сцепку между отдельными участками спирали.
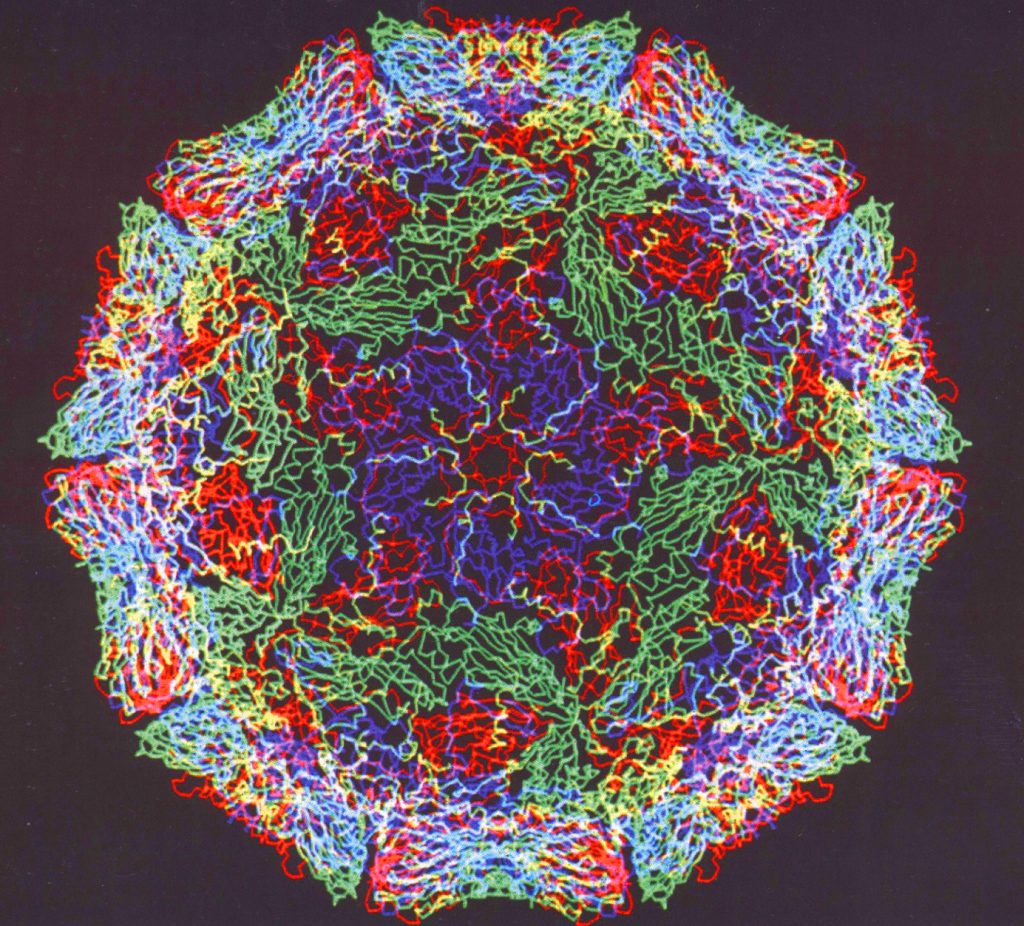
4. Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными. Однако прочность этих связей невелика и структура белка может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
Нарушение четвертичной, третичной и вторичной структур ↔обратимо↔.
Разрушение первичной структуры необратимо .
Белки имеют видовую специфичность: каждый вид организмов обладает белками, не встречающимися у других видов.
Состав, строение и функции белка в клетке, биологическое значение
Каждая клетка живого организма функционирует за счет содержания необходимых компонентов. Они выполняют важную роль, стимулируют обменные процессы и способствуют обновлению.
Особенно важны функции белка в клетке. Органические компоненты могут иметь разный состав, строение, некоторые отличия в жизненном цикле. Сегодня специалисты используют различные методы для исследования молекул и выявления их особенностей.

Что такое белки
Белки представляют собой органические соединения, имеющие различный состав и выполняющие важные функции в организме всех живых существ. Существует несколько видов этих молекул, каждый из которых имеет значение в процессе жизнедеятельности.
Состав
Органические вещества являются высокомолекулярными, поэтому могут включать в свой состав различные аминокислоты и другие соединения. Набор важных компонентов в каждой молекуле закладывается генетическим кодом животного или человека.
Основные компоненты каждой молекулы:
Первый компонент обнаруживается в белке в наибольшем количестве, последний — не более 5 % от состава.

История открытия
Первый белок был получен необычным способом. Его выделили из пшеничной муки в виде клейковины. Произошло открытие в 1728 году, сделал его Якопо Беккари, итальянец. В качестве отдельного биологического класса молекулы белка были выделены в XVIII веке после обнародования работ французского ученого и химика Антуана де Фуркруа.
Другие ученые одновременно с французом отметили, что молекулы имеют свойство коагулировать (объединяться) под воздействием некоторых кислот или в процессе нагревания.
На тот момент ученые смогли изучить только альбумин, фибрин и глютен.
Только через 100 лет, в XIX веке, другие исследователи, изучив состав простых белков, отметили, что при нагревании происходит выделение аминокислот. Это помогло сделать вывод, что молекулы включают в себя довольно большое количество важных и разных аминокислот, а состав каждой из них индивидуален.
В 1836 году Мульдер предложил первую структурную формулу белков, основанную на теории радикалов. Он и еще несколько ученых вывели формулу протеинов, что в переводе с греческого означает «первый». Мульдер также определил почти точную молекулярную массу наиболее простого белка, равную 131 дальтону. Дальтон — единица измерения молекул, называемая еще атомной массой или углеродной единицей.
Позже ученые выявили, что молекулярная масса может быть различной и зависит от состава и структуры органического соединения.
В 1880-х годах русский ученый Данилевский изучил пептидные группы и доказал их существование в белковой молекуле. К этому времени большинство аминокислот уже были изучены.
В 1894 году немецкий ученый и физиолог Альбрехт Коссель рассказал о своем предположении. Он считал, что именно аминокислоты являются основными структурными элементами белковой молекулы. Его теория была подтверждена в начале ХХ века химиком из Германии Эмилем Фишером. Ученый в ходе своего эксперимента доказал, что каждая молекула содержит около 20 аминокислот.
Важность белка в живом организме была признана только в 1926 году благодаря эксперименту американца Джеймса Самнера. После этого начинается активное изучение структур молекулы, выделяются различные виды. В 60—80-ых годах ХХ века исследования продолжаются.
К 2012 году в базе данных насчитывалось около 87 тысяч структур.
Сегодня методы изучения молекулы усовершенствованы, поэтому работа в этом направлении продолжается.

Строение
Белок считается макромолекулой, поскольку имеет большой размер и множество составляющих. В строении белков присутствуют разные аминокислоты или их остатки, они чередуются с полипептидными цепями.
В молекулу могут входить следующие аминокислоты:
- глицин;
- аланин;
- изолейцин;
- серин;
- лейцин;
- валин;
- треонин.
Эти встречаются в составе наиболее часто, сочетаются с пептидными цепями и аминокислотными остатками.

Классификация
Существуют несколько классификаций белков в зависимости от состава, строения, формы, растворимости в воде. Чаще всего молекулы делят на простые и сложные с учетом строения.
К простым относятся следующие:
- Альбумины — жизненно необходимы животным и человеку. Содержатся во многих продуктах, хорошо растворяются в воде, соленых жидкостях под воздействием кислот. Являются основной составляющей мышечных тканей в организме, формируют резерв на случай длительного голодания.
- Глобулины в воде слабо растворяются. Являются составляющими крови, мышечной ткани, оказывают влияние на свертываемость, выполняют защитную функцию.
- Протамины — низкомолекулярные белки, хорошо растворимые в воде. В организме выполняют структурную функцию, являются строительным материалом для мышц и других тканей.
- Гистоны — низкомолекулярные вещества, содержат большое количество лизина и аргинина. Принимают участие в формировании структуры молекул ДНК, предупреждают передачу генетической информации к РНК.
- Проламины — растительные белки с невысокой пищевой ценностью. Создают в организме резерв.
- Глютелины — растительные вещества, принимающие участие в формировании клеточной оболочки. Денатурация происходит в солевых растворах, в воде они не растворимы.
- Протеноиды — животные белки, богатые аминокислотами, не растворяются в воде, кислотах, щелочах, солевых жидкостях. Входят в состав костной, хрящевой ткани, связок, сухожилий.
Среди сложных белков выделяют фосфопротеины, гликопротеины, нуклеопротеины, липопротеины, хромопротеины, металлопротеины.
Каждый вид имеет свои особенности:
- Фосфопротеины — сложные белки, содержащие остатки фосфорной кислоты, связывающиеся с пептидными цепями. Выполняют в организме защитную, строительную, энергетическую функции.
- Гликопротеины — сложные органические компоненты, содержащие углеводный остаток. Принимают участие в выработке ферментов, выполняют защитную и секреторную функции, стимулируют образование важных для жизнедеятельности гормонов.
- Нуклеопротеины состоят из нуклеиновых кислот (нуклеотиды), наиболее распространенные РНК и ДНК. Содержатся в мембранах клетки, формируют генетический код человека.
- Липопротеины содержат липиды (жиры), присутствуют в лимфе и плазме крови, не растворяются в воде. Выполняют транспортировочную функцию, переносят липиды по всему организму.
- Хромопротеины называют «цветными белками». В составе содержат окрашивающий компонент. Участвуют в транспортировке кислорода. Яркий представитель вида — гемоглобин.
- Металлопротеины содержат ионы металла в составе. Транспортируют металл в организме, создают его резерв.
Любой из видов играет важную роль в метаболических процессах.

Функции
Различные виды белков выполняют в организме важные функции. При отсутствии основных типов нарушаются все жизненно важные процессы.
Каталитическая
Катализ реакций в организме осуществляется благодаря наличию ферментов, являющихся белками по своему составу и строению. Ферменты помогают расщеплять сложные вещества на простые, облегчают их переработку.
Благодаря этому возможно поступление полезных компонентов ко всем тканям, органам, регенерация клеток, осуществление нормального метаболизма.

Структурная
Осуществляется благодаря коллагену и эластину. Белки являются важным строительным элементом, стимулируют формирование костной ткани, мышц, хрящей, связок и сухожилий.
Выделяют 4 структуры белковой молекулы:
- Первичная структура представляет собой последовательность остатков аминокислот, чередующихся с полипептидной цепью. Встречается во многих тканях, на протяжении жизни организма не меняет строения.
- Вторичная структура — упорядочивание фрагментов полипептидной цепи, подверженное стабилизации за счет наличия водородных связей.
- Третичная структура — строение полипептидной цепи пространственного типа. При детальном рассмотрении можно увидеть, что строение напоминает вторичную структуру, но присутствуют гидрофобные взаимодействия.
- Четвертичная структура представляет собой белковое соединение, состоящее из нескольких пептидных цепей в одном комплексе.
Благодаря различной структуре белковых молекул осуществляется построение всех клеток и тканей в организме.

Защитная
Физическая защита осуществляется благодаря наличию в клетках и тканях коллагена, отвечающего за прочность и предотвращающего повреждения. Химическая защита осуществляется благодаря способности белков связывать токсины, выводить их из организма.
Иммунная защита возможна благодаря способности некоторых белков стимулировать образование лимфоцитов, уничтожать вирусы, патогенные микроорганизмы.

Сигнальная и регуляторная
Регуляция всех процессов в клетках осуществляется с участием белков, представленных ферментами. Часто компоненты связываются с другими веществами, стимулируют процессы регенерации, регулируют метаболизм.
Многие внутриклеточные белки осуществляют сигнальную функцию, помогают передавать информацию между тканями, клетками, органами. Обычно сигнальную функцию выполняют белки-гормоны.

Транспортная
Транспортная функция осуществляется в основном за счет белка-гемоглобина. Он доставляет кислород ко всем тканям и клеткам, переправляет в легкие углекислый газ для выведения его наружу.
Ученые нашли во всех живых организмах молекулы, напоминающие по строению гемоглобин.

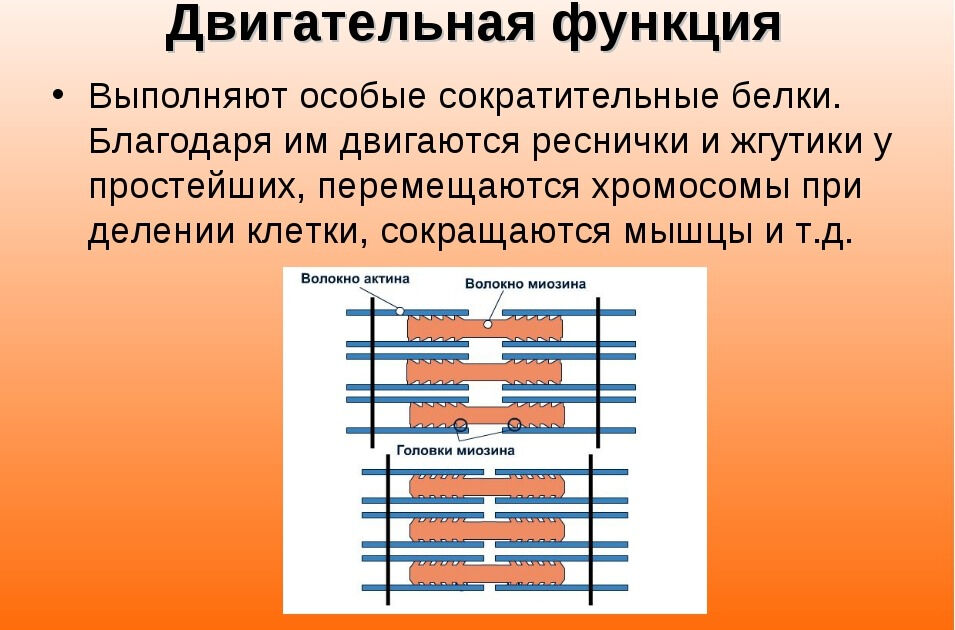
Запасная и моторная
Запасная или резервная функция возможна благодаря наличию в клетке белков, содержащих аминокислоты. Они служат источником питания и энергии при недостаточном поступлении подобных компонентов с пищей.
Моторная или двигательная функция играет важную роль. Разные виды белковых молекул принимают участие в сокращении мышечных волокон, передвижении лейкоцитов и других клеток для обеспечения иммунной защиты.
Свойства
Белковые соединения обладают физическими и химическими свойствами, отличающими их от других молекул.
Физические
Физические свойства позволяют выявить белок среди других соединений в живом организме.
Основными будут следующие:
- вес молекулы может достигать 1 млн дальтон;
- при попадании в водный раствор происходит формирование коллоидной системы;
- в зависимости от кислотности среды отличается заряд белкового соединения;
- самый крупный сегодня белок — титин.
Молекулярная масса у каждого соединения отличается, определяется разными способами.

Химические
При определенных условиях белковые соединения проявляют свои химические свойства.
Наиболее частыми реакциями будут следующие:
- Амфотерность — способность белков в зависимости от условий проявлять основные свойства и кислотные.
- Денатурация — изменение биологической активности соединения в результате потери вторичной, третичной или четвертичной структуры. Может быть механической, физической и химической, обратимой и необратимой, полной и неполной.
Химические свойства белков изучаются различными методами для выявления особенностей молекул.

Этапы синтеза белка
Биосинтез белка представляет собой процесс, состоящий из нескольких этапов, в ходе которых происходит созревание соединений. Протекает во всех живых организмах.
Основные этапы синтеза:
- Инициация. Образование аминоацеладинелата одновременно с активацией аминокислоты в присутствии АТФ и специфического фермента.
- Элонгация. Присоединение образовавшейся кислоты к специфичной тРНК с последующим освобождением аденозинмнофосфата.
- Терминация. Связывание соединения аминокислоты и тРНК с рибосомами.
- Трансляция. Включение аминокислоты в белковую молекулу с одновременным высвобождением тРНК.
У разных живых организмов процесс может проходить с разной скоростью, но последовательность этапов неизменна.

Методы изучения
Сегодня исследование белковых соединений продолжается в современных лабораториях.
Популярные методы изучения:
- Метод клеточной и молекулярной биологии используется с целью фиксирования локализации молекул в клетках, наблюдения за синтезом веществ. Для стимулирования реакции используются антитела. Наблюдение проводится посредством микроскопа. На предметное стекло помещается подготовленный белок и антитела, проводится эксперимент, результаты фиксируются.
- Биохимический метод предполагает изучение чистого белка, избавленного от дополнительных компонентов. Для дальнейшего изучения используют центрифугирование, высаливание, электрофокусирование.
- Протеомика — наука, изучающая совокупность белковых соединений в составе одной клетки. Для исследования используются специальные приборы, соединения, белковые микрочипы, позволяющие изучать сразу несколько молекул в клетке.
Благодаря новейшим современным методикам возможно прогрессирование науки в области исследования живых клеток и их составляющих.

Биологическое значение
Биологическое значение органических соединений объясняется множеством полезных функций. Компоненты принимают участие во всех жизненно важных процессах в организме, являются незаменимым строительным материалом, стимулируют выработку лимфоцитов, отвечающих за стойкость иммунной системы животного или человека.
При отсутствии сложных белков невозможно образование гормонов, новых клеток и регенерация тканей. Без белковых молекул в организме не осуществляется процесс дыхания, поскольку невозможен перенос кислорода и выведение углекислого газа.
Особенно важное значение имеют белки для человека, поскольку некоторые виды помогают связывать и выводить из организма токсины, вредные соединения. Длительное отсутствие в питании белка приводит к постепенному истощению и смерти организма.

Интересные факты
Некоторые интересные факты о белковых соединениях доказывают важность их в живых организмах.
Наиболее интересными считаются следующие:
- Около 50 % от сухого веса организма приходится на белки.
- Вирусы почти полностью состоят из этого компонента, некоторые на 95 %.
- Более 30 % органических веществ у человека концентрируется в мышцах.
- Клетки головного мозга состоят преимущественно из белковых молекул.
- Волосы на теле и голове человека представлены ороговевшими клетками, состоящими из белковых молекул.
- Недостаток вещества в пище отрицательно отражается на всех процессах.
- В более чем 50 % случаев аллергия на белок у человека проявляется в детском возрасте.
- Человеку одинаково необходим растительный и животный белок.
- Детям белковые соединения необходимы в больших количествах, чем взрослым.
- Яичный белок считается наиболее качественным и легко усваивается.
Белки в организме — незаменимый и необходимый ежедневно компонент, позволяющий обеспечивать здоровье и правильное функционирование клеток.
6. Белки: строение, свойства, функции
Среди органических веществ клетки самыми разнообразными по свойствам и выполняемым функциям являются белки , или протеины . В белках, в отличии от углеводов и липидов, кроме углерода, кислорода и водорода содержится азот, а также могут присутствовать атомы серы, фосфора и железа.
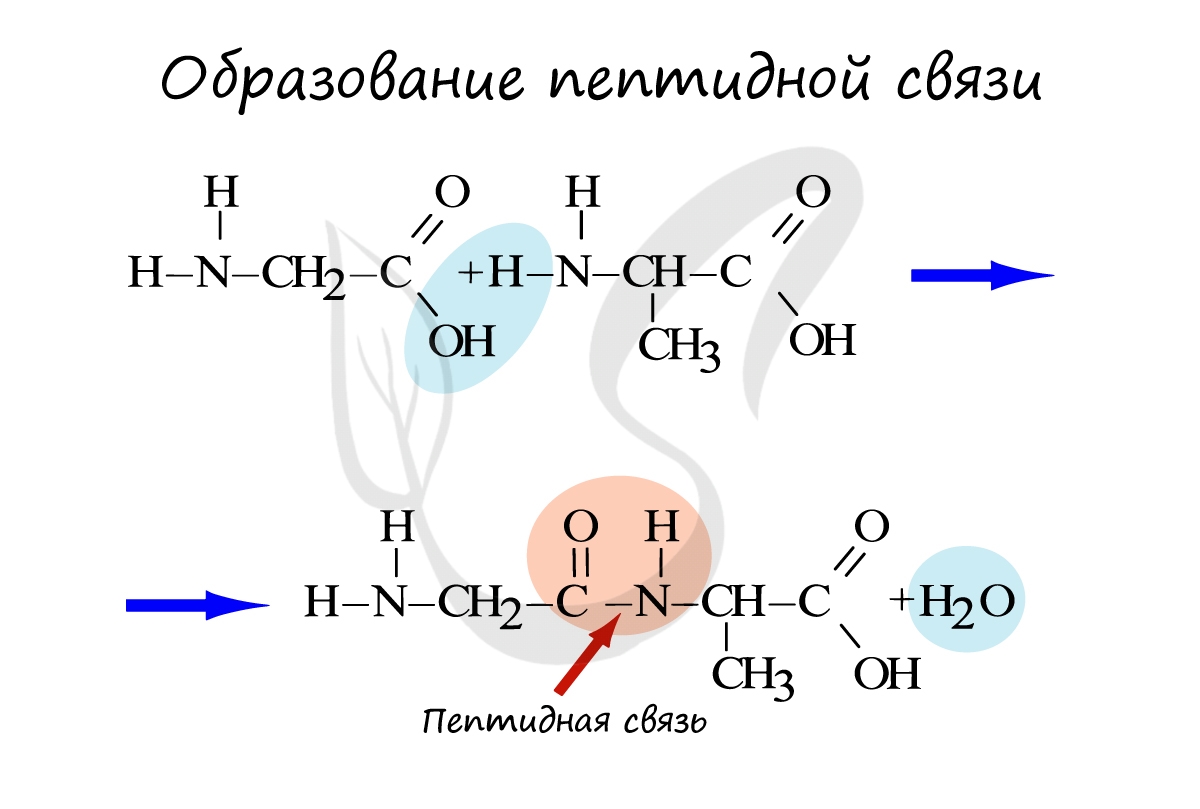
Белки — это биополимеры, мономерами в которых служат аминокислоты . В образовании всего разнообразия белков участвует (20) α -аминокислот. Молекулы аминокислот имеют две функциональные группы: карбоксильную (кислотную) и аминогруппу (основную).

Аминогруппа и карбоксильная группа способны взаимодействовать между собой с отщеплением воды и образованием пептидной связи CO − NH . Пептидными связями молекулы аминокислот соединяются друг с другом в длинные цепи. Число остатков аминокислот в цепи может составлять несколько сотен и даже тысяч. Такие большие молекулы называют макромолекулами.
Порядок соединения аминокислот в макромолекуле белка называют первичной структурой. Для каждого типа белка эта структура уникальна. Она определяет структуры высших уровней, свойства белка и его функции.
Полипептидная цепь сворачивается в спираль за счёт образования водородных связей между группировками атомов − NH и − CO , расположенными на разных участках макромолекулы. Эту спираль называют вторичной структурой белка.
Третичная структура белка возникает при взаимодействии радикалов аминокислот, а также за счёт дисульфидных мостиков, водородных и ионных связей. Молекула белка принимает форму глобулы (шарика).
У некоторых белков формируется четвертичная структура. Она представляет собой комплекс нескольких макромолекул, имеющих третичную структуру. Четвертичную структуру удерживают непрочные ионные и водородные связи, а также гидрофобные взаимодействия.

Белки могут соединяться с углеводами, жирами и нуклеиновыми кислотами с образованием комплексных соединений: гликопротеинов, липопротеинов, нуклеопротеинов.
Под действием внешних факторов: облучения, нагревания, некоторых химических веществ и др. — происходит нарушение пространственной структуры белковых молекул. Этот процесс называется денатурацией.
Сначала происходит разрушение четвертичной структуры, потом третичной и вторичной. Первичная структура при денатурации сохраняется, но белок утрачивает свои свойства и функции.

Разрушение первичной структуры необратимо. Оно происходит при гидролизе белка — макромолекулы распадаются на отдельные аминокислоты. Такой процесс идёт в органах пищеварения животных и в лизосомах клеток под действием гидролитических ферментов.
1. Важнейшей функцией белков является каталитическая, или ферментативная. Белки-ферменты участвуют во всех биохимических реакциях, протекающих в клетке, и повышают скорость этих реакций во много раз. Для каждой реакции существует особый фермент.
2. Белки выполняют структурную (строительную) функцию. Они входят в состав плазматических мембран, образуют соединительные ткани (эластин и коллаген), волосы и ногти (кератин).

3. Сигнальную функцию также осуществляют белки, встроенные в мембрану. Под действием внешних факторов эти белки изменяют третичную структуру, что отражается на функционировании клетки.
4. Транспортная функция белков проявляется в переносе ионов через клеточные мембраны, транспорте гемоглобином крови кислорода и углекислого газа, альбуминами плазмы — жирных кислот и т. д.
5. Двигательную функцию обеспечивают белки актин и миозин, способные сокращаться и растягиваться. Они приводят в движение реснички и жгутики одноклеточных организмов, сокращают мышцы у животных.

6. Защитная функция обеспечивается антителами иммунной системы организма, белками системы свёртывании крови (фибриногеном, протромбином и др.).
7. Регуляторную функцию выполняют белки-гормоны (инсулин, тиреотропин, соматотропин, глюкагон и др.).
8. Энергетическую функцию белки выполняют после израсходования запасов углеводов и жиров. При полном расщеплении (1) г белка до конечных продуктов выделяется (17,6) кДж энергии.
Строение и функции белков

ГОСТ
Строение белков
Белки – сложные органические соединения (биополимеры), в состав молекул которых входят углерод, водород, кислород и азот (иногда серы). Их мономеры – аминокислоты.
Белки играют первостепенное значение в жизни всех организмов. Они характеризуются неисчерпаемым разнообразием, которое одновременно очень специфично.
Белки и нуклеиновые кислоты являются материальной основой всего богатства организмов окружающей среды. Их доля составляет 50 – 80% сухой массы клетки.
Молекулы белков похожи на длинные цепи, состоящие из 50 – 1500 остатков аминокислот, соединённых крепкой ковалентной азотно-углеродной (пептидной) связью. В результате образуется первичная структура белка – полипептидная цепь.
Молекула белка – это полипептид, молекулярная масса которого составляет от 5 тыс. до 150 тыс. Бывает и больше.
Простые белки состоят лишь из аминокислот, а сложные белки, кроме аминокислот, могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), углеводы (гликопротеиды), окрашенные химические соединения (хромопротеиды) и т.п.
Все свойства клетки (химические, морфологические, функциональные) зависят от специфических белков, содержащихся в ней.
Именно набор аминокислот, их количество и последовательность расположения в полипептидной цепи и определяет специфичность белка.
Замена лишь одной аминокислоты в составе белковой молекулы или изменение последовательности расположения аминокислот может привести к изменению функций белка. Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Готовые работы на аналогичную тему
Пространственное расположение полипептидных цепей также определяет свойства белков. В живой клетке полипептидные цепи скрученные или согнутые, имеют вторичную или третичную структуру.
Вторичная структура представлена спирально закрученной белковой цепочкой. Витки спирали удерживаются благодаря водородным связям, образующимся между расположенными на соседних витках СО – и NH – группами.
В результате дальнейшего закручивания спирали возникает специфическая конфигурация каждого белка – третичная структура. Образуется она благодаря связям между белковыми радикалами аминокислотных остатков:
- ковалентным дисульфидным (S – S-связям) между остатками цистеина,
- водородным,
- ионными.
- гидрофобным взаимодействиям.
В количественном соотношении наиболее важными являются гидрофобные взаимодействия, вызванные тем, что неполярные боковые цепи аминокислот стремятся объединиться друг с другом, не смешиваясь с водной средой. Белок при этом свёртывается так, чтобы его гидрофобные боковые цепи были спрятаны внутри молекулы, то есть защищены от контакта с водой, а наружу, наоборот, выставлены боковые гидрофильные цепи.
Для каждого белка специфичны количество молекуламинокислот с гидрофобными радикалами и количество молекул цистеина и характер их взаимного расположения в полипептидной цепи.
Взаимное расположение групп атомов, обходимое для проявления активности белка как катализатора, его гормональных функций и др. обеспечивается сохранением определённой формы молекулы. Потому стойкость макромолекул – не случайное свойство, а один из важнейших способовстабилизации организма.
Биологическая активность белка может проявлятся лишь когда он имеет третичную структуру, потому при замене в полипептидной цепи даже одной аминокислоты могут возникнуть изменения в конфигурации белка, а его биологическая активность снизится или же исчезнет совсем.
Иногда две, три, и больше белковых молекул с третичной структурой могут объединиться в единый комплекс. Подобные образования являются четвертичной структурой белка.
Примером такого сложного белка является гемоглобин, который состоит из четырёх субединиц и небелковой части – гема. Он способен выполнять свои функции только в такой форме.
В четвертичной структуре белковые субединицы не связаны химически, однако вся структура достаточно крепкая благодаря действию слабых межмолекулярных сил.
Под влиянием разнообразных физических и химических факторов (обработка щелочами, кислотами, спиртом, ацетоном, влияние высоких температур и давления и пр.) третичная и четвертичная структуры белка изменяются, потому что разрываются водородные и ионные связи.
Денатурация – нарушение естественной (нативной) структуры белка.
При денатурации уменьшается растворимость белков, изменяется форма и размеры молекул, теряется ферментативная активность и т.п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
Все особенности строения и функционирования белковой макромолекулы зависят от его первичной структуры.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
- Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Ферменти, их роль в клетке
Ферменты (энзимы) – это специфические белки, присутствующие во всех организмах и выполняющие функцию биологических катализаторов.
Химические реакции в живой клетке происходят при умеренной температуре нормальном давлении и в нейтральной среде. При таких условиях течение реакций синтеза или распада веществ в клетке был быочень медленным, если бы не действие ферментов. Ферменты ускоряют реакции за счёт снижения энергии активации не измененяя их общего результата, то есть при их наличии для придания молекулам, вступающим в реакцию, реакционной способности, необходимо значительно меньше энергии
Все процессы в живом организме прямо или косвенно происходят с участием ферментов.
Под действием ферментов составляющие компоненты пищи (белки, липиды, углеводы и др.) расщепляются до простейших соединений, а из них позже синтезируются новые, свойственные данному виду макромолекулы. Потому нарушение образования и активности ферментов часто становятся причиной тяжёлых заболеваний.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от последнего характеризируется чрезвычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует лишь на один тип связи). Этим обеспечивается тонкое регулирование всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и т. п.), происходящих в клетке и организме.
Фермент уреаза катализирует расщепление только одного вещества – мочевины, но не действует каталитически на структурно родственные соединения.
Для понятия механизма действия ферментов, которые имеют высокую специфичность, чрезвычайно важна теория активного центра. Согласно с ней, в молекуле каждого фермента есть один или больше участков, в которых катализ происходит за счёт тесного (во многих местах) контакта между молекулами фермента и субстрата (специфического вещества), а функциональная группа (пример – ОН – группа аминокислоты серина), или же отдельная аминокислота, выступает активным центром.
Обычно для действия катализатора необходимо, чтобы объединились несколько аминокислотных остатков, расположенных в определённой последовательности (в среднем 3 – 12).
Активный центр также может формироваться благодаря связи ферментов с ионами металов, витаминами и другими соединениями небелковой природы – так называемыми коферментами, или кофакторами.
Химическое строение и форма активного центра такова, что с ним способны связывать лишь определённые субстраты благодаря их идеальному соответствию (взаимодополняемости, или комплементарности) друг другу.
Остальные аминокислотные остатки обеспечивают большой молекуле ферментп соответствующую глобулярную форму, необходимую для эффективной работы самого центра.
Кроме того, вокруг большой молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими ассиметрической формы. В результате ослабевают химические связи и начальная затрата энергии на реакцию, которая катализируется, будет меньше, а значит, значительно увеличится её скорость.
Одна молекула фермента каталазы способна за 1 мин расщепить более 5 млн. молекул перекиси водорода, которая возникает во время окисления в организме различных соединений.
Активный центр некоторых ферментов в присутствии субстрата может изменять конфигурацию: для обеспечения наибольшей каталитической активности такой фермент специально ориентирует свои функциональные группы. Молекулы субстрата, присоединяясь к ферменту, также в определённых пределах изменяют свою конфигурацию для увеличения реакционной способностит функциональных групп центра. На заключительном этапе химической реакции комплекс фермента и субстрата распадается, образуются конечные продукты и свободный фермент. Активный центр при этом освобождается и способен снова принимать новые молекулы субстрата.
Скорость реакций с участием ферментов зависит от многих факторов: от концентрации фермента, от природы субстрата, от давления, температуры, кислотности среды, от наличия ингибиторов.
При температурах, близких к 0˚С, до минимума замедляется скорость биохимических реакций. Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.
Для консервации органы человека (почки, серце, селезёнка, печень) перед пересадкой больному подвергают охлаждению, чтобы понизить интенсивность биохимических реакций и тем самым продлить время жизни этих органов. При быстром замораживании пищевых продуктов предотвращается размножение микроорганизмов, а так же инактивируются их ферменты, потому они уже не способны вызывать разложение пищевых продуктов.
Неорганические и органические вещества клетки
Задумайтесь! Мы с вами состоит из миллиардов атомов. Все атомы находятся в круговороте, и все атомы, которыми мы обладаем, в ком-то и где-то находились те 4,5 млрд. лет, которые существует Земля. Они были частями животных, растений, грибов и бактерий – а сейчас принадлежат нам на короткое время.

С химической точки зрения ответ на вопрос “Жив ли изучаемый объект?” – не представляется возможным. Понятию “жизнь” дано колоссальное количество определений. Жизнь – это самовоспроизведение с изменением, способ существования белковых тел, постоянный обмен веществ с внешней средой.
Мы приступаем к изучению неорганических и органических веществ клетки. Начнем с неотъемлемого компонента клетки, благодаря которому жизнь на Земле в принципе стала возможна – вода.
Составляет 60-80% массы клетки. Молекула воды обладает уникальным свойством – полярностью, которое возникает из-за разницы в электроотрицательности (ЭО) между атомами кислорода и водорода (у кислорода ЭО больше).

Поскольку молекула воды полярна, ее называют диполь. Между молекулами воды возникают непрочные водородные связи: водородная связь начинается от отрицательно заряженного атома кислорода (2δ – ) одной молекулы воды и тянется до положительно заряженного атома водорода другой молекулы воды (δ + )
- Гидрофильные (греч. hydro – вода и philéo – люблю) – вещества, которые хорошо растворяются в воде. Гидрофильными веществами являются сахара, соли, альдегиды, спирты, аминокислоты.
- Гидрофобные (греч. hydro – вода и phobos — страх) – вещества, которые не растворяются в воде. Гидрофобными веществами являются жиры.
-
Вода – универсальный растворитель
Большинство реакций, которые протекают в клетке, идут в растворе (водной среде). Полярность молекулы воды позволяет ей быть отличным растворителем для других гидрофильных (полярных) веществ.
Вода может поглощать теплоту при минимальном изменении температуры. Это настоящее “спасение” для клеток: чуть только температура меняется, вода начинает поглощать избыток тепла, защищая клетку от перегревания. Выделяясь на поверхность кожи с потом, вода испаряется, поверхность кожи при этом охлаждается.
Она не только создает среду для реакций в клетке, но и сама активно участвует во многих из них. Расщепление питательных веществ, попавших в клетку, происходит за счет реакции гидролиза (греч. hydro – вода и lysis – расщепление).
Питательные вещества, газы перемещаются по организму с током крови. Вода составляет 90-92% плазмы крови, является ее основным компонентом. С помощью воды происходит не только доставка веществ к клеткам, но и удаление из организма побочных продуктов обмена веществ.

Вода придает тканям тургор (лат. turgor — наполнение) – внутреннее осмотическое давление в живой клетке, создающее напряжение оболочек клеток. Вода составляет от 60 до 95% цитоплазмы, придает клеткам форму. Изменение тургора клеток растений приводит к перемещениям их частей, раскрытию устьиц, цветков.
Осмотическое давление – избыточное гидростатическое давление на раствор, отделенный от чистого растворителя с помощью полупроницаемой мембраны.
Главное – понимать суть: если мы поместим живую клетку в гипертонический раствор, то вода (растворитель) устремится из клетки в раствор (в сторону большей концентрации соли) – это приведет к сморщиванию клеток.
Если же клетка окажется в гипотоническом растворе, то вода извне устремится внутрь клетки (опять-таки в сторону большей концентрации солей), приводя при этом к разбуханию (и возможному разрыву) клетки.

Элементы
- Биогенные (основные) – C, H, O, N. Входят в состав органических соединений, составляют основную часть клетки
- Макроэлементы (греч. makrós – большой) – составляют десятые и сотые доли в клетке: K, Na, Ca, Mg, Cl, P, S
- Микроэлементы (греч. mikrós – маленький) – составляют тысячные доли в клетке: Zn, Cu, I, Co, Mn, Fe
Процентное содержание элемента не коррелирует с его важностью и биологической значимостью. Так, к примеру, микроэлемент I играет важную роль в синтезе гормонов щитовидной железы: тироксина, трийодтиронина. За нормальные рост и развитие организмов отвечают Zn, Mn, Cu.
Благоприятно влияют на сперматозоиды Zn, Ca, Mg, защищая их от оксидативного стресса (окисления). Невозможным становится нормальное образование эритроцитов без должного уровня Fe и Cu.

В водной среде клетки соли диссоциируют (распадаются) на положительно заряженные ионы – катионы (Na + , K + , Ca 2+ , Mg 2+ ) и отрицательно заряженные – анионы (Cl – , SO4 2- , HPO4 2- , H2PO4 – ).
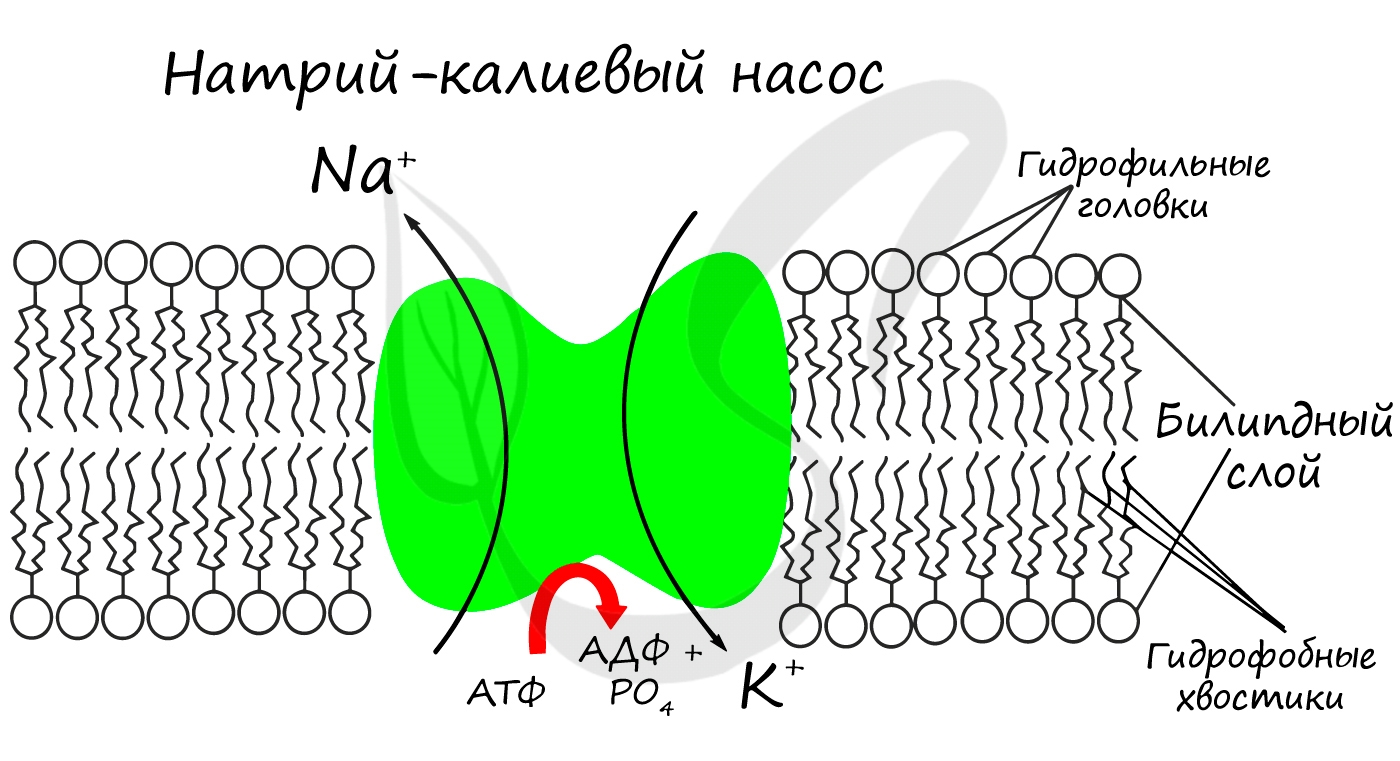
Для процессов возбуждения клетки (нейрона, миоцита – мышечной клетки) внутри клетки должна поддерживаться низкая концентрация ионов Na + и высокая концентрация ионов K + . В окружающей клетку среде все наоборот: много Na и мало K. В мембране существует специальный натрий-калиевый насос, который поддерживает необходимое равновесие. Если это соотношение нарушится, то нейрон не сможет сгенерировать нервный импульс, а клетка мышцы – сократиться.
- Участвуют в активации ферментов
- Создают буферные системы (бикарбонтаную, фосфатную, белковую)
- Поддерживают кислотно-щелочное состояние (КЩС)
- Создают осмотическое давление клетки
- Создают мембранный потенциал клеток (натрий-калиевый насос)
- Являются основным минеральным составляющим скелета внутреннего и наружного (у моллюсков)

Мы переходим к органическим компонентам клетки, к которым относятся: жиры, углеводы, белки и нуклеиновые кислоты.
Белки, или пептиды (греч. πεπτος – питательный)
Белки – полимеры, мономерами которых являются аминокислоты. Белки представляют линейную структуру, образованную из длинной цепи аминокислот, между которыми возникают пептидные связи. Пептидная связь образуется между карбоксильной группой (COOH) одной аминокислоты и аминогруппой другой аминокислоты (NH2).
Между понятиями пептиды и белки существует определенная разница. Белки состоят из сотен тысяч аминокислот. Пептидами называют небольшие белки, содержащие до 10 аминокислот. Ими являются некоторые гормоны: окситоцин, вазопрессин, тиреолиберин – эти пептиды выполняют регуляторную функцию.
- Первичная – полипептидная цепь, в которой аминокислоты расположены линейно
- Вторичная – полипептидная цепь закручивается в спираль, формируется α или β структура
- Третичная – спирали скручиваются в глобулу (лат. globulus – шарик)
- Четвертичная – образуется у сложных белков путем соединения нескольких глобул

При резком изменении оптимальных для белка условий он подвергается денатурации: при этом происходит переход от высших структур организации к низшим, или “раскручивание белка”. Важно заметить, что аминокислотная последовательность (первичная структура белка) при этом не меняется, однако свойства белка меняются кардинально (теряется его гидрофильность).
Осмелюсь сделать заявление: вы часто начинаете свой день с денатурации белка. Простейший способ провести такой эксперимент – пожарить яичницу. Заметьте, что изначально яичный белок прозрачный и текучий, но по итогу жарки эти свойства утрачиваются: он становится непрозрачным и вязким.
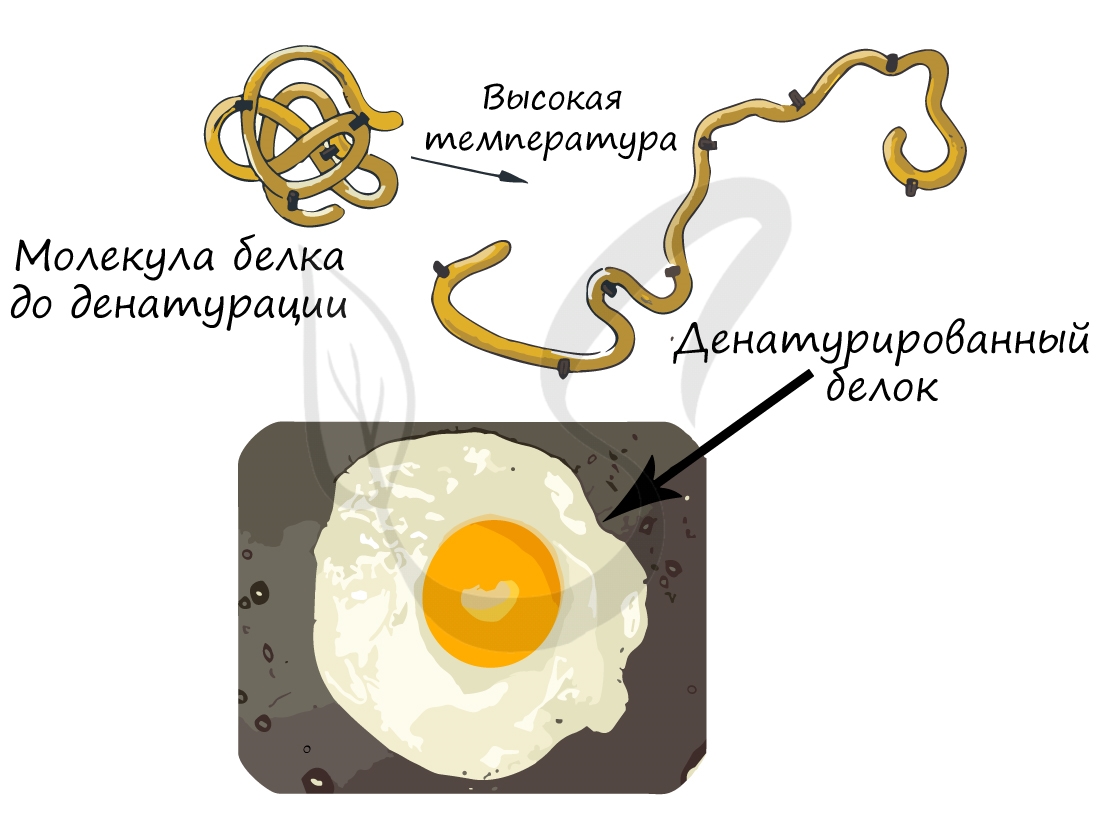
-
Каталитическая (греч. katalysis – разрушение)
Белки – природные катализаторы, ускоряющие реакции в организме в десятки и сотни тысяч раз. Эту роль главным образом выполняют белки-ферменты (энзимы).
Иногда в состав белков входят так называемые ко-факторы – небелковые соединения, которые необходимы ферменту для его биологической активности (в роли ко-факторов могут выступать Zn 2+ , Mg 2+ ).
Белки входят в состав клеточных мембран. Сложные белки: коллаген, эластин – входят в состав соединительных тканей организма, придавая им некоторую прочность и эластичность.
Некоторые гормоны, регулирующие обменные процессы в организме, имеют белковое происхождение: инсулин, глюкагон, адренокортикотропный гормон (АКТГ).
Говоря об этой функции, прежде всего, стоит вспомнить об антителах – иммуноглобулинах, которые синтезируют B-лимфоциты. Антитела нейтрализуют чужеродные организму антигены (разрушают бактерии).

Помимо антител, защитную функцию выполняют также белки свертывающей системы крови (тромбин и фибриноген): они предохраняют организм от кровопотери.
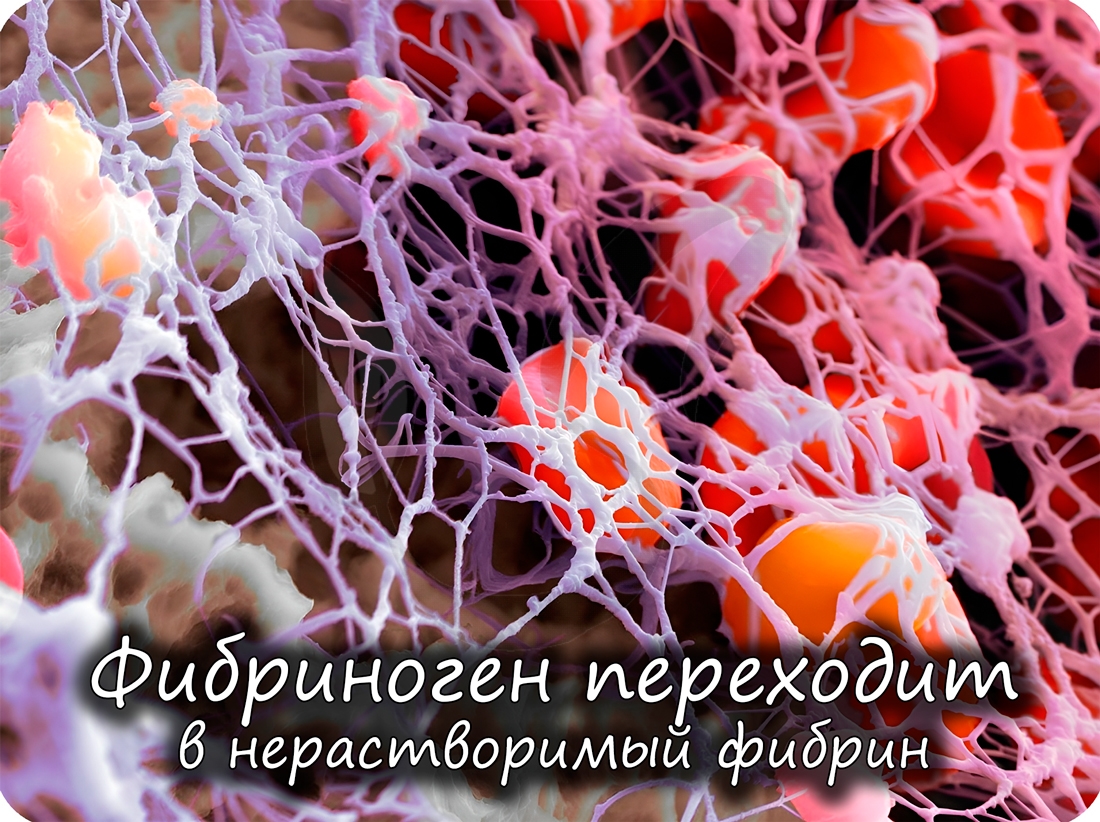
При недостаточном питании в организме начинают окисляться молекулы белков. При расщеплении 1 г белков выделяется 17,6 кДж энергии.
Некоторые белки крови способны присоединять к себе и переносить различные молекулы. Альбумины участвуют в транспорте жирных кислот, глобулины – гормонов и некоторых ионов (Fe, Cu). Основной белок эритроцитов – гемоглобин – способен переносить кислород, углекислый и угарный газы (угарный конечно нежелательно ему переносить, будет отравление)
Двигательные белки, актин и миозин, на уровне саркомера обеспечивают сокращение мышц. При возбуждении мышечной ткани тонкие нити актина начинают тереться о толстые нити миозина, приводя к сокращению.
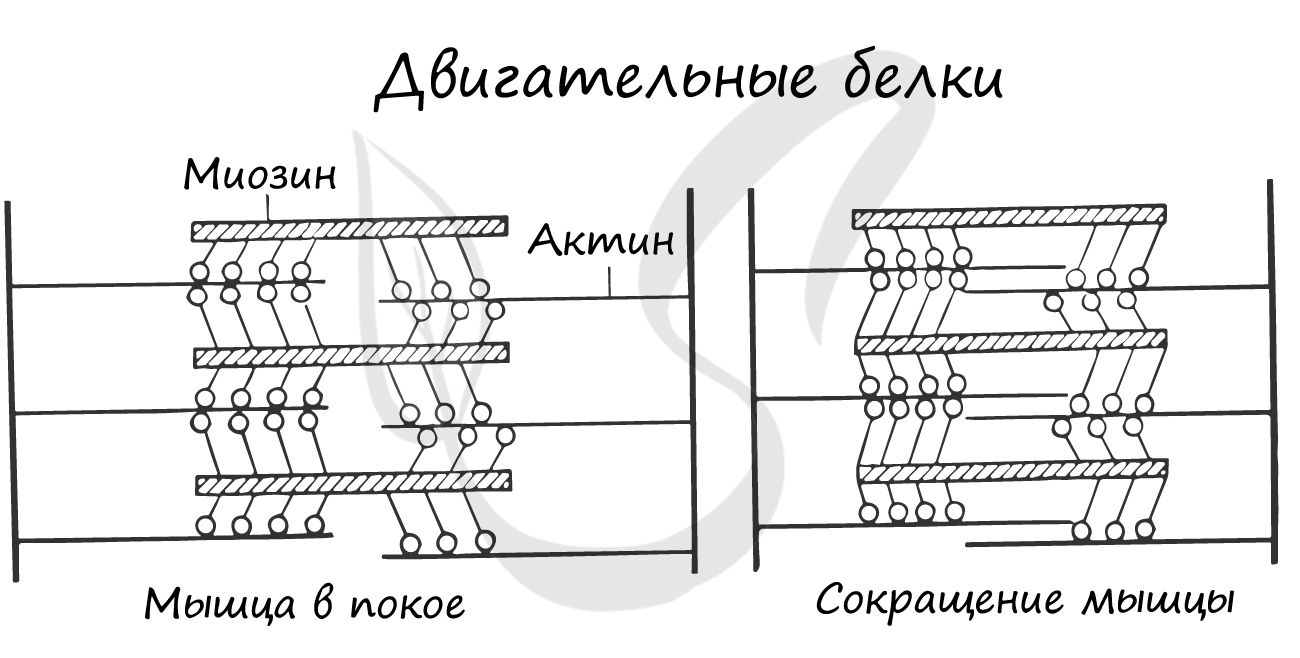
На поверхности мембраны белки образуют многочисленные рецепторы, которые, соединяясь с гормонами, приводят к изменению обмена веществ в клетке. Таким образом, гормоны реализуют воздействие на клетки органов-мишеней.
Жиры, или липиды (греч. lipos – жир)
С химической точки зрения жиры являются сложными эфирами, образованными трехатомным спиртом глицерином и высшими карбоновыми кислотами (жирными кислотами). Среди их свойств надо выделить то, что они практически нерастворимы в воде. Вспомните, как тяжело смыть жир с рук водой.
Почему именно мыло смывает жир с рук? Дело в том, что молекула мыла повторяет свойства жира: одна часть ее гидрофобна, а другая гидрофильна. Мыло соединяется с молекулой жира гидрофобной частью, и вместе они легко смываются водой.
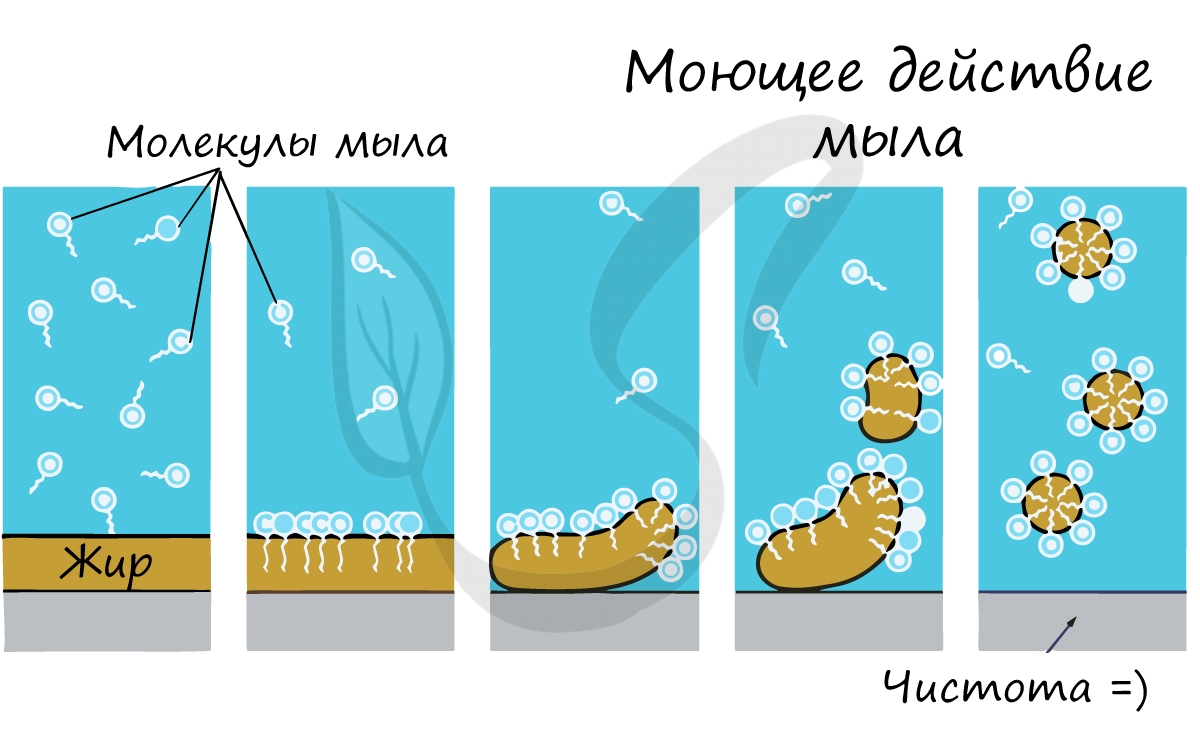
При окислении жиров выделяется много энергии: 1 г – 38,9 кДж. Это вдвое больше выделяющейся энергии при расщеплении 1г углеводов.
Жиры имеют способность накапливаться в клетках, расположенных в подкожно-жировой клетчатке, внутренних органах. Эти запасы являются резервом организма на случай голодания или при недостаточном питании.
В жирах также запасается вода: в 100 г жира содержится 107 мл воды. Многим пустынным животным (верблюдам) жировые запасы помогают длительное время обходиться без воды.
Жиры входят в состав биологических мембран клеток человека вместе с белками. Из фосфолипидов построены мембраны всех клеток органов и тканей!
Так, к примеру, холестерин – обязательный компонент мембраны, придает ей определенную жесткость и совершенно необходим для нормальной жизнедеятельности (заболевания возникают только при нарушении липидного обмена).

Жиры обладают плохой теплопроводностью. Располагаясь в подкожно-жировой клетчатке, они образуют термоизолирующий слой. Особенно хорошо он развит у ластоногих (моржи и тюлени), китов, защищает их от переохлаждения.
Некоторые гормоны по строению относятся к жирам: половые (андрогены – мужские и эстрогены – женские), гормон беременности (прогестерон), кортикостероиды.
Производное жира – витамин D – принимает важное участие в обмене кальция и фосфора в организме. Он образуется в коже под действием ультрафиолетового излучения (солнечного света). При недостатке витамина D возникает заболевание – рахит.

Углеводы
-
Моносахариды (греч. monos — единственный)
Простые сахара, легко растворяющиеся в воде и имеющие сладкий вкус. Моносахариды подразделяются на гексозы (имеют 6 атомов углерода) – глюкоза, фруктоза, и пентозы (имеют 5 атомов углерода) – рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот.
При гидролизе олигосахариды распадаются на моносахариды. В состав олигосахаридов может входить от 2 до 10 моносахаридных остатков. Если в состав олигосахарида входят 2 остатка моносахарида, то его называют дисахарид. К дисахаридам относятся сахароза, лактоза, мальтоза. При гидролизе сахароза распадается на глюкозу и фруктозу.
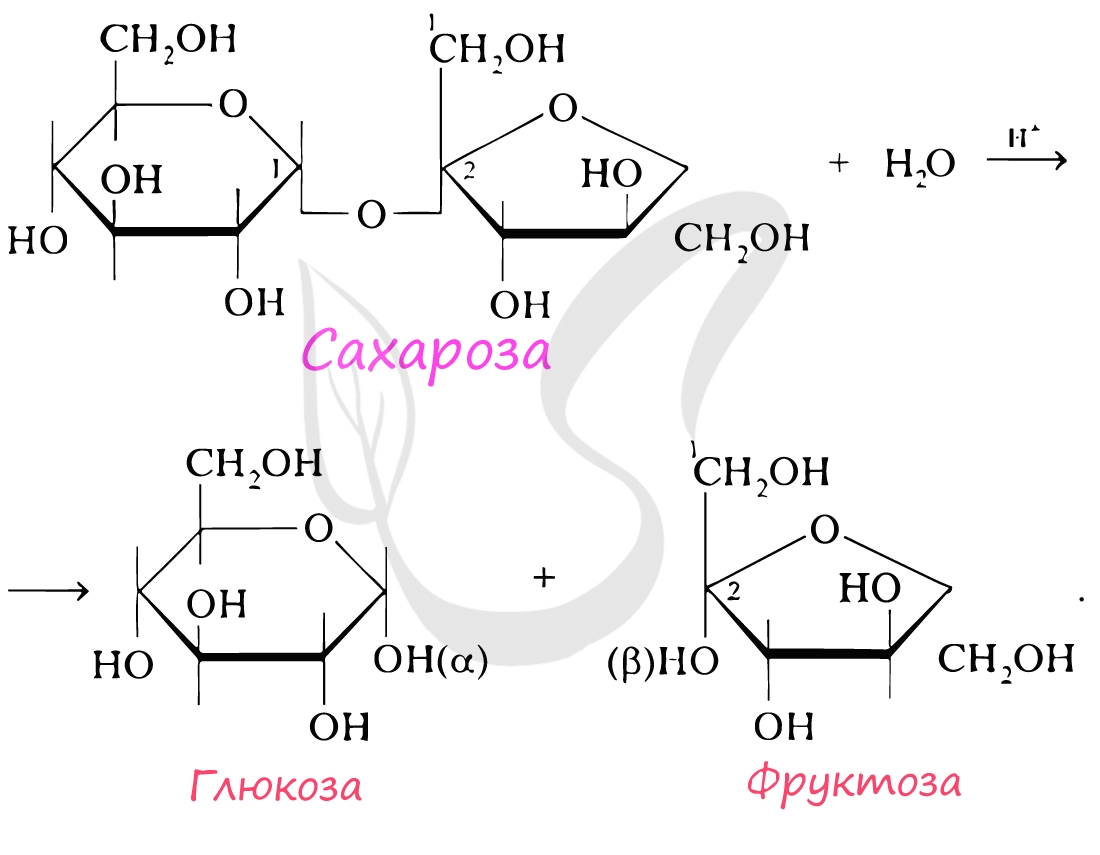
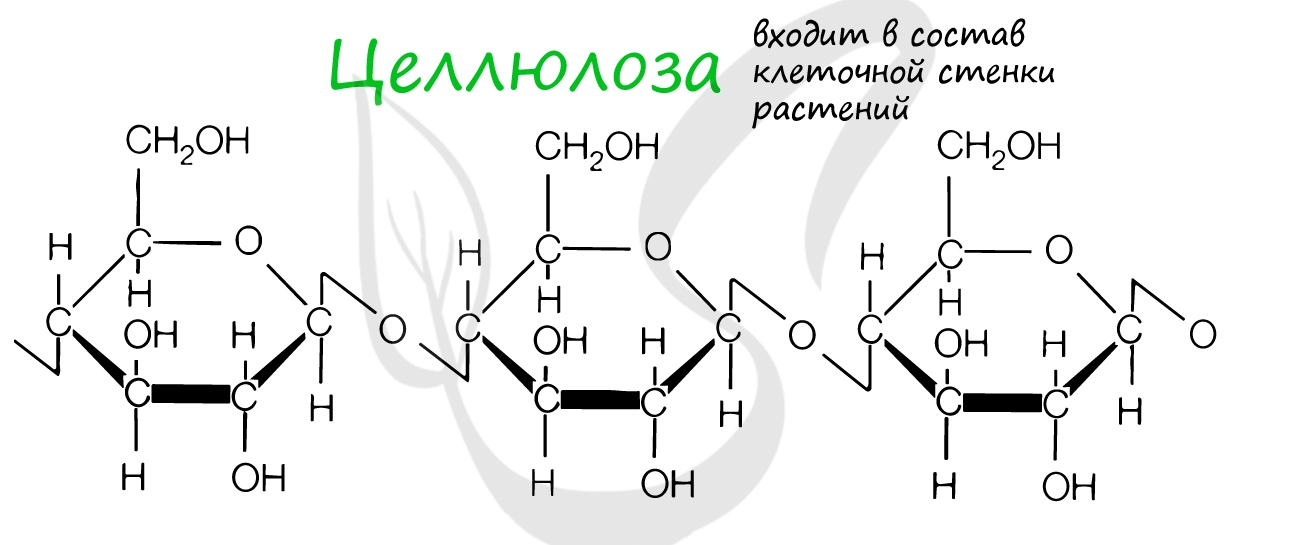
Это биополимеры, в состав которых входят сотни тысяч моносахаридов. Они обладают высокой молекулярной массой, нерастворимы в воде, на вкус несладкие.
Крахмал, целлюлоза, гликоген, хитин и муреин – все это биополимеры. Давайте вспомним, где они находятся.
Клеточная стенка образована: у растений – целлюлозой, у грибов – хитином, у бактерий – муреином. Запасным питательным веществом растений является крахмал, животных – гликоген.
В результате расщепления 1 г углеводов высвобождается 17,6 кДж энергии.
Запасным питательным веществом растений и животных соответственно являются крахмал и гликоген. Расщепление гликогена позволяет нам оставаться в сознании и быть активными между приемами пищи.
Гликоген представляет собой разветвленную молекулу, состоящую из остатков глюкозы. За счет больших размеров такая молекула хорошо удерживается в клетке, а ее разветвленность позволяет ферментам быстро отщеплять множество молекул глюкозы одновременно.
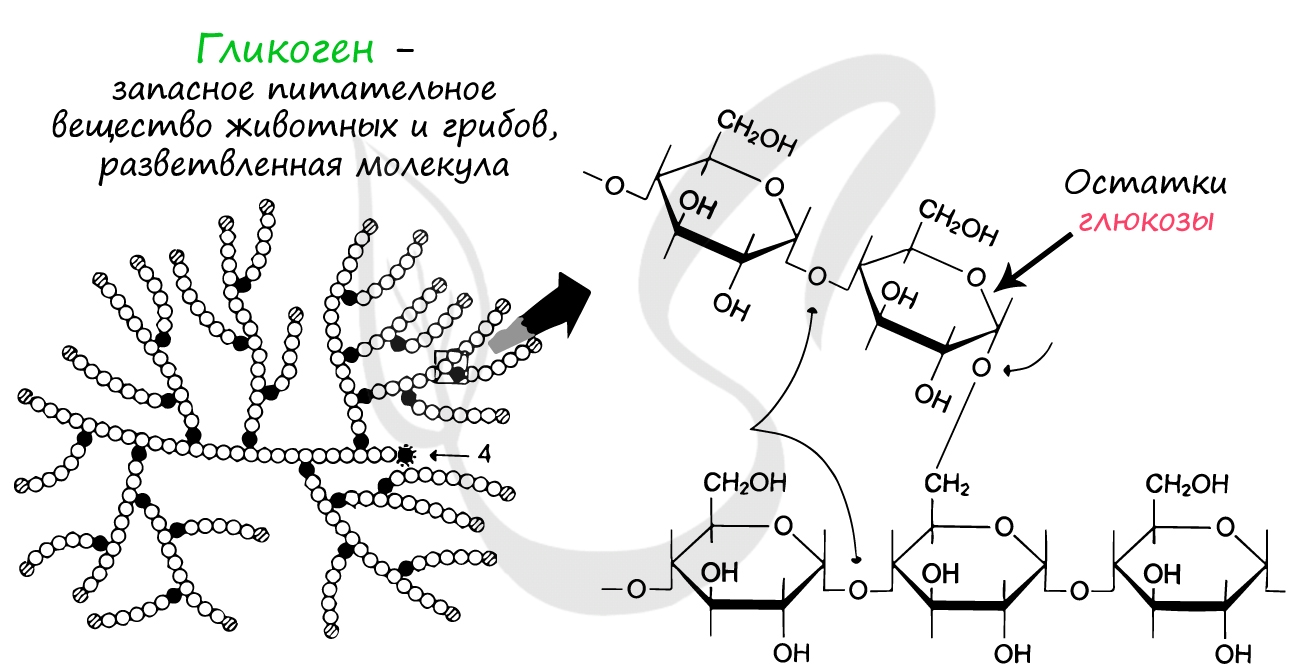
Существуют заболевания, при которых распад гликогена нарушается: в результате нейроны не получают глюкозы (источника энергии, соответственно не синтезируются и молекулы АТФ). Из-за этого становятся возможны частые потери сознания.
Целлюлоза входит в состав клеточных стенок растений, придавая им необходимую твердость. Хитин образует клеточную стенку грибов и наружный скелет членистоногих.

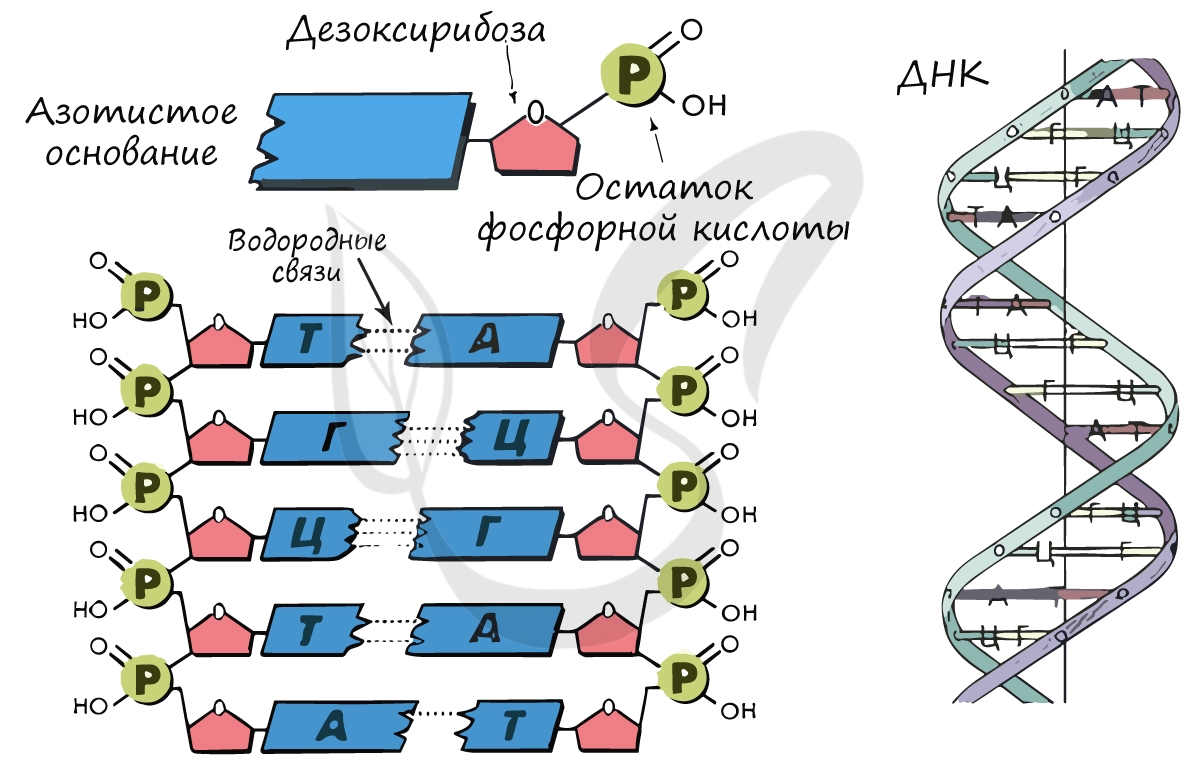
Нуклеиновые кислоты (от лат. nucleus — ядро)
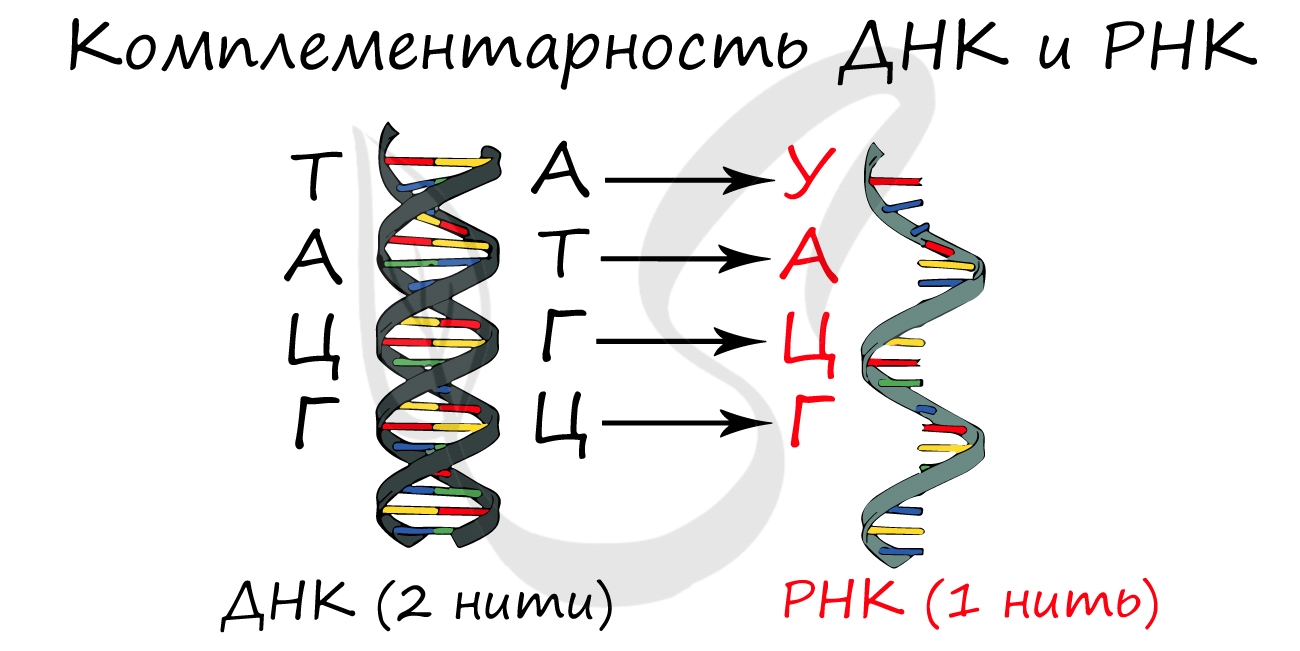
Для ДНК характерны следующие азотистые основания: аденин – тимин, гуанин – цитозин; для РНК: аденин – урацил, гуанин – цитозин. Исходя из принципа комплементарности, данные основания соответствуют друг другу, в результате чего между ними образуются связи.
Между аденином и тимином образуется 2 водородные связи, а между гуанином и цитозином – 3.
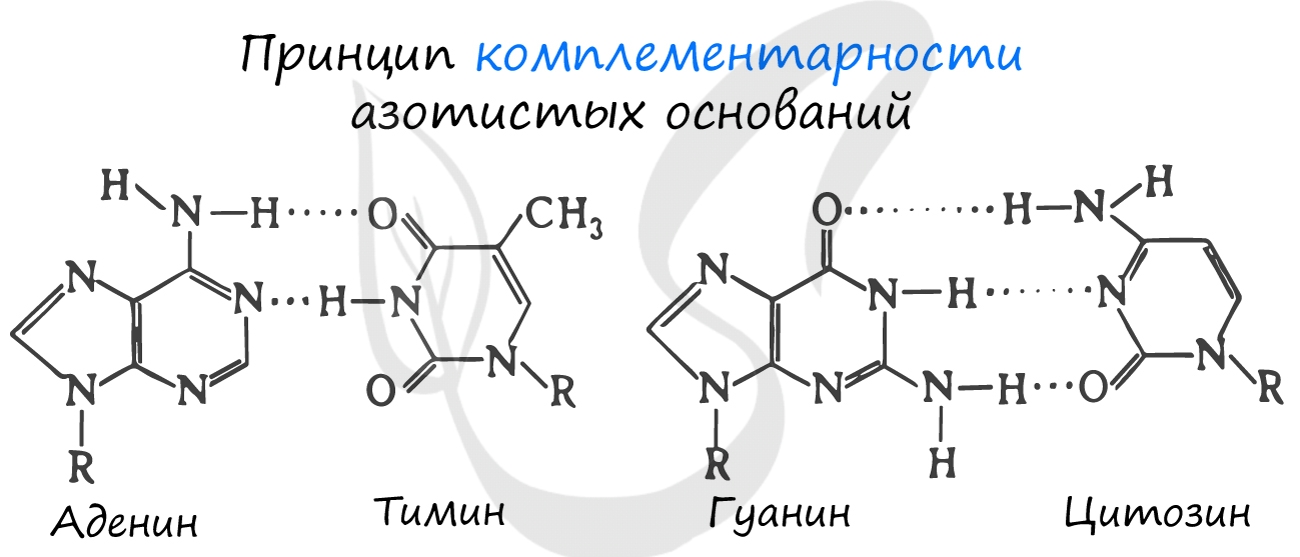
Именно по этой причине количество аденина в молекуле ДНК всегда совпадает с количеством тимина. К примеру, если в ДНК 20% аденина, то с уверенностью можно сказать, что в ней 20% тимина. Выходит на оставшиеся основания – цитозин и гуанин – остается 60%, значит, цитозин и гуанин составляют в ДНК 30% каждый. Таким нехитрым образом, зная процент содержания одного основания, можно подсчитать все остальные.
В ДНК остаток сахара – дезоксирибоза, в РНК – рибоза.
-
Рибосомальная РНК (рРНК)
Синтезируется в ядрышке. рРНК входит в состав малых и больших субъединиц рибосом. В процентном отношении рРНК составляет 80-90% всей РНК клетки.
Синтезируется в ядре в ходе процесса транскрипции (лат. transcriptio — переписывание). Фермент РНК-полимераза строит цепь иРНК по принципу комплементарности с ДНК. Исходя из данного принципа, гуанин (Г) в молекуле ДНК соединяется с цитозином (Ц) в РНК. Далее соответственно: цитозин (Ц) – гуанин (Г), аденин (А) – урацил (У), тимин (Т) – аденин (А).
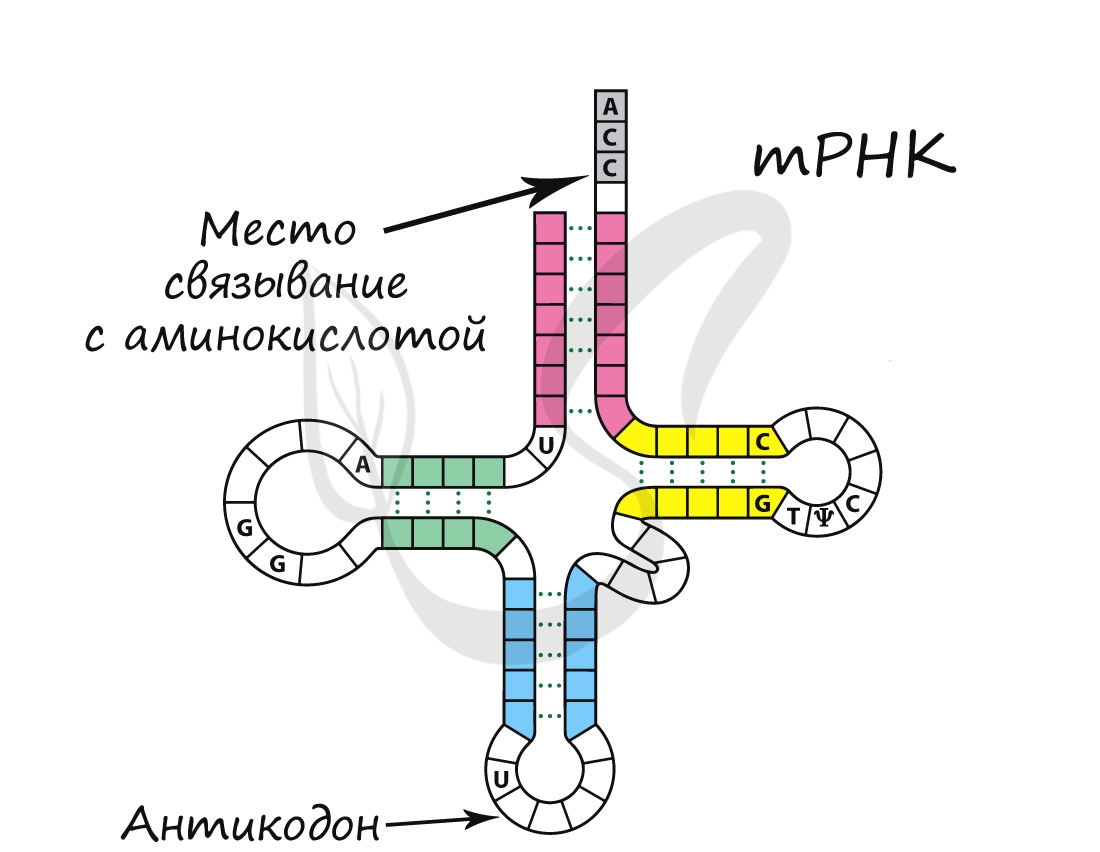
Обеспечивает транспорт аминокислоты к рибосоме во время синтеза белка. Благодаря этому становится возможным соединение аминокислот друг с другом, образуется белок. тРНК имеет характерную форму клеверного листа.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.





