Одноосновные предельные карбоновые кислоты
Одноосновные предельные карбоновые кислоты (одноосновные насыщенные карбоновые кислоты) — карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой -COOH. Все они имеют общую формулу СnH2n+1COOH
Номенклатура
Систематические названия одноосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса -овая и слова кислота.
Изомерия
Изомерия скелета в углеводородном радикале проявляется, начиная с бутановой кислоты, которая имеет два изомера:
Межклассовая изомерия проявляется, начиная с уксусной кислоты:
- CH3-COOH уксусная кислота;
- H-COO-CH3метилформиат (метиловый эфир муравьиной кислоты);
- HO-CH2-COH гидроксиэтаналь (гидроксиуксусный альдегид);
- HO-CHO=CH2гидроксиэтиленоксид.
Гомологический ряд
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
|---|---|---|---|
| Муравьиная кислота | Метановая кислота | HCOOH | формиаты |
| Уксусная кислота | Этановая кислота | CH3COOH | ацетаты |
| Пропионовая кислота | Пропановая кислота | C2H5COOH | пропионаты |
| Масляная кислота | Бутановая кислота | C3H7COOH | бутираты |
| Валериановая кислота | Пентановая кислота | C4H9COOH | валераты |
| Капроновая кислота | Гексановая кислота | C5H11COOH | капраты |
| Энантовая кислота | Гептановая кислота | C6H13COOH | энантоаты |
| Каприловая кислота | Октановая кислота | C7H15COOH | каприлаты |
| Пеларгоновая кислота | Нонановая кислота | C8H17COOH | пеларогоаты |
| Каприновая кислота | Декановая кислота | C9H19COOH | капринаты |
| Ундециловая кислота | Ундекановая кислота | C10H21COOH | ундеканоаты |
| Лауриновая кислота | Додекановая кислота | C11H23COOH | лаураты |
| – | Тридекановая кислота | C12H25COOH | тридеканоаты |
| Миристиновая кислота | Тетрадекановая кислота | C13H27COOH | миристиаты |
| – | Пентадекановая кислота | C14H29COOH | пентадеканоат |
| Пальмитиновая кислота | Гексадекановая кислота | C15H31COOH | пальмитаты |
| Маргариновая кислота | Гептадекановая кислота | C16H33COOH | маргараты |
| Стеариновая кислота | Октадекановая кислота | C17H35COOH | стеараты |
| – | Нонадекановая кислота | C18H37COOH | нонадеканоаты |
| Арахиновая кислота | Эйкозановая кислота | C19H39COOH | арахаты |
| – | Генэйкозановая кислота | C20H41COOH | генэйкозаноаты |
| Бегеновая кислота | Докозановая кислота | C21H43COOH | бегенаты |
| – | Трикозановая кислота | C22H45COOH | трикозаноаты |
| Лигноцериновая кислота | Тетракозановая кислота | C23H47COOH | лигноцераты |
| – | Пентакозановая кислота | C24H49COOH | пентакозаноаты |
| Церотиновая кислота | Гексакозановая кислота | C25H51COOH | церотитаты |
| – | Гептакозановая кислота | C26H53COOH | гептакозаноаты |
| Монтановая кислота | Октакозановая кислота | C27H55COOH | монтаноаты |
| – | Нонакозановая кислота | C28H57COOH | нонакозаноаты |
| Мелиссовая кислота | Триаконтановая кислота | C29H59COOH | мелиссаты |
| – | Гентриаконтановая кислота | C30H61COOH | Гентриаконтаноаты |
| – | Дотриаконтановая кислота | C31H63COOH | Дотриаконтаноаты |
| Псилластеариловая кислота | Тритриаконтановая кислота | C32H65COOH | псилластеарилаты |
- Одноосновные предельные карбоновые кислоты
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое “Одноосновные предельные карбоновые кислоты” в других словарях:
Одноосновные насыщенные карбоновые кислоты — Одноосновные предельные карбоновые кислоты (одноосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой COOH. Все они имеют общую формулу СnH2n+1COOH, где n … Википедия
Предельные монокарбоновые кислоты — Одноосновные предельные карбоновые кислоты (одноосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой COOH. Все они имеют общую формулу СnH2n+1COOH, где n … Википедия
Насыщенные монокарбоновые кислоты — Одноосновные предельные карбоновые кислоты (одноосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой COOH. Все они имеют общую формулу СnH2n+1COOH, где n … Википедия
Валериановые кислоты — н пентановая (валериановая) кислота Валериановая кислота (пентановая кислота) С4Н9COOH – одноосновная предельная карбоновая кислота, бесцветная жидкость с неприятым запахом. Соли и эфиры валериановой кислоты называют валератами. Валериановая… … Википедия
Одноосновные карбоновые кислоты: получение, физические и химические свойства
Низшие жирные кислоты – это легкоподвижные с резким запахом жидкости, средние члены – масла с неприятным прогорклым запахом, высшие – твердые кристаллические вещества без запаха.
Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях, с ростом молекулярной массы растворимость быстро уменьшается, для высших членов гомологического ряда она равна нулю.
Температуры кипения и плавления увеличиваются с ростом числа атомов углерода, но не равномерно. Кислоты с четным числом атомов углерода имеют более высокие температуры плавления, по сравнению со следующими за ними кислотами с нечетным числом атомов углерода. Жирные кислоты имеют два ряда температур плавления – один ряд охватывает кислоты с четным числом атомов углерода, другой – с нечетным. В обоих рядах разности температур плавления двух соседних кислот постепенно уменьшаются (см. табл.)

Такое своеобразное различие между карбоновыми кислотами с четным и нечетным числом атомов углерода отчасти проявляется и в химических и биологических свойствах.
Карбоновые кислоты сильно ассоциированы и показывают вдвое больший молекулярный вес, чем это следует из их простой молекулярной формулы даже при температурах, выше их температур кипения.
Как и у спиртов ассоциация обусловлена наличием ОН-группы, водородный атом которой связывается водородной связью с атомом кислорода другой молекулы кислоты.
Получение карбоновых кислот
- Присоединение натрий алкилов к двуокиси углерода:
- Присоединение алкилмагниевых солей (реактив Греньяра) к двуокиси углерода:
- Способ Реппе. Нагревание олефинов, окиси углерода и воды в присутствии катализатора Ni(CO)4 при 200 атм и 270°С:
- Окисление первичных спиртов и альдегидов кислородом воздуха в присутствии катализаторов или хромовой кислотой, KМnО4и K2Сr2О7:

- Окисление парафинов – промышленный способ:
RCH2CH2R’ + 5/2O2 = RCOOH + R’COOH + H2O
Окисление осуществляют при катализе реакции солями кобальта или марганца.
R-COOR`+ КОН →R-COOK+R`OH
R-COOK + HCl → R-COOH + KCl

- Гидролиз галоидных алкилов осуществляют основанием или водой при катализе апротонными кислотами, например, FeCl3
- Гидролиз ангидридов карбоновых кислот:
- Гидролиз галогенангидридов карбоновых кислот:
RCOHal + H2O = RCOOH + HHal
- Метод Арндта и Эйстерта основан на взаимодействии хлорангидрида кислоты с диазометаном. Образующийся диазокетон обрабатывают водой в присутствии серебра, платины или меди:
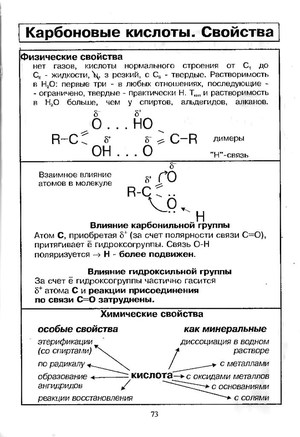
Химические свойства одноосновных насыщенных карбоновых кислот
Одноосновные карбоновые кислоты обладают высокой реакционной способностью, причем в молекуле кислоты присутствуют одновременно несколько реакционных центров:
- О-Н-Кислотный центр. За счет подвижного водорода ОН группы характерно проявление кислотных свойств.
- Электрофильный центр – атом углерода карбоксильной группы. Благодаря этому центру кислоты и их производные вступают в реакции нуклеофильного замещения.
- Основный центр – оксогруппа (карбонильная группа), имеющая пару электронов. Способна к протонированию (присоединению водорода), в реакциях нуклеофильного замещения.
- С-Н – кислотный центр – возникает в алкильном радикале у α-углеродного атома благодаря индуктивному эффекту карбоксильной группы. При этом возникает возможность реакции конденсации, а также замещения водорода при этом центре.

I. Реакции с разрывом в карбоксильной группе связи O─H
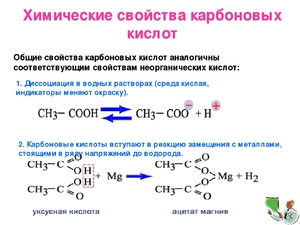
- Диссоциация кислот в водных растворах происходит с отщеплением водорода:
R-COOH ↔ R-COO − + Н +
Карбоновые кислоты в водных растворах частично подвергаются электролитической диссоциации, которая по сравнению с минеральными кислотами незначительна. Все органические кислоты являются слабыми, тем не менее, они имеют свойственные минеральным кислотам химические свойства. Самая сильная среди одноосновных кислот – муравьиная (Н-СООН).
Заместители в молекуле кислоты способствуют возникновению индукционного эффекта, вследствие чего кислотность кислоты, а значит и ее сила уменьшается или растет в зависимости от природы заместителя. Так, электронодонорые заместители (например, алкильные заместители) понижают кислотность (силу) кислот, а электроноакцепторные (например, Cl, Вr, I) – увеличивают кислотность (силу) кислот.

Водные растворы карбоновых кислот изменяют окраску индикаторов.
- Образование солей карбоновых кислот
а) Взаимодействие кислот с металлами, стоящими в ряду напряжения металлов до водорода, приводит к образованию соли и выделению водорода:

б) Взаимодействие кислот с основными и амфотерными оксидами приводит к образованию соли и воды:
в) Реакция нейтрализации — взаимодействие кислот с щелочами, нерастворимыми основаниями и амфотерными гидроксидами к образованию соли и воды:
г) Взаимодействие кислот с аммиаком NH3 и гидроксидом аммония NH4OH:
Н–СООН + NH3 → Н–СООNH4 (формиат аммония)
г) Взаимодействие кислот с солями, образованными более слабыми или летучими кислотами:

II. Реакции, протекающие с разрывом C─O связи (замещение OH-группы)
Гидроксильная группа карбоновых кислот очень реакционноспособна и может замещаться многими атомными группами или отдельными атомами, например, Сl, SH, NH2, NHNH2, N3, NHOH
- Реакция этерификации — взаимодействие кислот со спиртами с образованием сложных эфиров:

Механизм реакции этерификации:

- Взаимодействие с аммиаком с образованием амидов кислот. На первой стадии реакции образуется аммониевая соль, на второй стадии при нагревании соли происходит отщепление воды и образование амида кислоты:

- Взаимодействие с галогенирующими агентами. Чаще всего используют хлорсодержащие соединения (галогениды фосфора — PCl3, PCl5, тионилхлорид — SO2Cl):

- Межмолекулярная дегидратация. Реакция протекает под действием температуры, в присутствии водоотнимающего агента – Р2О5 с образованием ангидридов кислот:

Исключением является муравьиная кислота межмолекулярная дегидратация которой приводит к образованию окиси углерода СО:

III. Реакции с разрывом связей C─H у α-углеродного атома углеводородного радикала
Реакции замещения. В молекуле карбоновой кислоты атомы водорода при втором атоме углерода (α-углеродного атома) являются наиболее подвижными по сравнению с другими водородными атомами. Поэтому они способны замещаться, например, на атом галогена в присутствии красного фосфора с образованием α-галогенкарбоновых кислот:

IV. Восстановление карбоновых кислот
Карбоксильная группа восстанавливается с большим трудом. Чтобы восстановить ее до метильной группы, требуется длительное нагревание с концентрированной йодистоводородной кислотой и фосфором и даже в этом случае восстановление протекает не до конца. Прямое восстановление карбоновых кислот водородом достигается применением высоких давлений и температур в присутствии катализаторов (Cu, Co, Zn-Cr-Cu-Cd катализатор) по способу Шраута-Нормана. Этот способ используют в промышленности для получения из высших жирных кислот первичных спиртов, которые используют в получении моющих средств. Наиболее легко восстановление кислот происходит с помощью алюмогидрида лития (LiAlH4) или диборана (B2H6):

V. Окисление (горение) карбоновых кислот.
Карбоновые кислоты, в отличие от альдегидов, довольно устойчивы к действию окислителей. И только муравьиная кислота, благодаря особенностям своего строения может окисляться до углекислого газа.
Однако все кислоты могут гореть в кислороде (жесткое окисление), образуя углекислый газ (СО2) и воду:

VI Декарбоксилирование карбоновых кислот
- Одноосновные карбоновые кислоты довольно устойчивы, отщепление их карбоксильной группы в виде СО2 происходит при высокой температуре:

- Наличие в молекуле кислоты электроноакцепторных заместителей в α-положении облегчает процесс декарбоксилирования:

- При сплавлении натриевых солей карбоновых кислот с NaOH, также происходит декарбоксилирование:

- Синтез Кольбе. При электролизе растворов или расплавов карбоновых кислот или их солей происходит декарбоксилирование с образованием алканов:

Отличительные свойства муравьиной кислоты
В молекуле метановой (муравьиной) кислоты сочетаются две группы – карбонильная и карбоксильная. Поэтому наряду со всеми свойствами кислот она обладает свойствами альдегидов:
Получение одноосновных предельных кислот
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10 −5 . Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание “овая” и слово “кислота“. При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН – пропановая кислота, СН3-С(СН3)2-СООН – 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание “карбоновая” и слово “кислота“, не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН – циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН – трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
Названия одноосновных карбоновых кислот
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
| Муравьиная кислота | Метановая кислота | HCOOH | формиаты |
| Уксусная кислота | Этановая кислота | CH3COOH | ацетаты |
| Пропионовая кислота | Пропановая кислота | C2H5COOH | пропионаты |
| Масляная кислота | Бутановая кислота | C3H7COOH | бутираты |
| Валериановая кислота | Пентановая кислота | C4H9COOH | валераты |
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
· ароматические (бензойная кислота)
· алифатические (в том числе предельные (капроновая кислота) и непредельные (акриловая кислота))
· алициклические (хинная кислота)
По числу карбоксильных групп кислоты могут быть:
· одноосновными (уксусная кислота)
· двухосновными щавелевая кислота)
· многоосновными (лимонная кислота)
Получение одноосновных предельных кислот



· Карбоксилирование металлорганических соединений


· Гидролиз сложных эфиров

Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)


Используется для получения высших гомологов кислот из низших.
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенномуравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи в них в большей степени поляризованы по типу Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
Химические свойства
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1. Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов:



2. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:


3. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):

4. При нагревании аммонийных солей карбоновых кислот образуются их амиды:


5. Под действием карбоновые кислоты превращаются в соответствующие хлорангидриды:
Химические свойства карбоновых кислот, формула одноосновной предельной кислоты, реакции получения

Карбоновые кислоты
Ключевые слова конспекта: Карбоновые кислоты. Предельные одноосновные карбоновые кислоты. Муравьиная кислота. Уксусная кислота.
Понятие и формулы карбоновых кислот
На любой кухне найдётся столовый уксус — 6%-ный раствор уксусной кислоты в воде. Наверняка в кухонном шкафу лежит и пакетик с лимонной кислотой, а в холодильнике — кисломолочные продукты, характерный вкус которым придаёт молочная кислота. Многие из вас пробовали на вкус прутик, атакованный муравьями в растревоженном муравейнике. Кислый вкус прутика обусловлен «химическим оружием» муравьёв — муравьиной кислотой.

Что общего между всеми упомянутыми веществами, кроме слова «кислота» в названии? Все они содержат в своём составе функциональную карбоксильную группу:
Органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом, называют карбоновыми кислотами .

Органических кислот великое множество. Мы будем знакомиться с предельными одноосновными карбоновыми кислотами, в молекулах которых с предельным углеводородным радикалом связана одна карбоксильная группа. Общая формула этих кислот СnН2n+1СООН, или RCOOH.
Однако в молекуле первого представителя гомологического ряда предельных одноосновных карбоновых кислот вместо углеводородного радикала с карбоксильной группой связан атом водорода. Эту кислоту называют муравьиной кислотой, её формула НСООН.
Формулы, а также тривиальные и международные названия некоторых представителей гомологического ряда предельных одноосновных карбоновых кислот приведены в таблице.
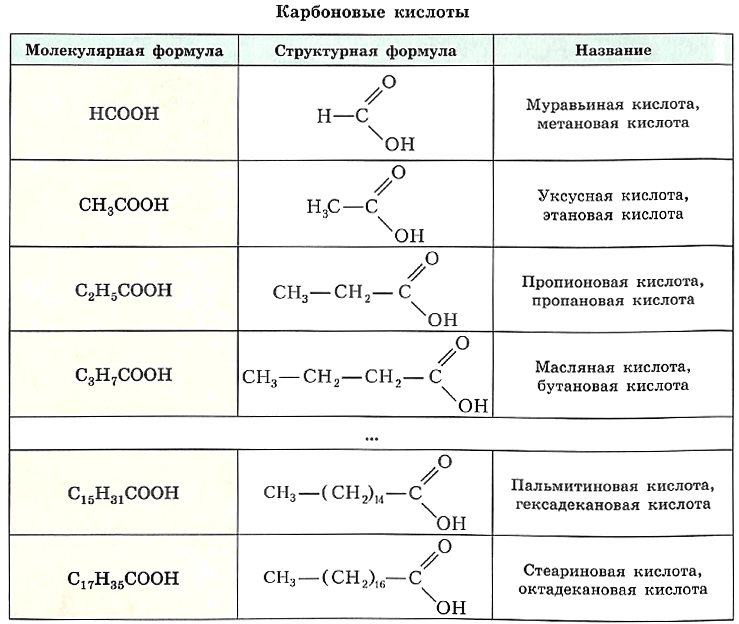
Обратите внимание, что тривиальные названия простейших альдегидов (см. табл.) аналогичны названиям соответствующих кислот. Это не случайно, поскольку свои названия альдегиды получили именно благодаря кислотам, в которые они превращаются при окислении. Для построения международного названия карбоновой кислоты к «имени» предельного углеводорода с тем же числом углеродных атомов добавляют сочетание —овая кислота.
Физические свойства и способы получения карбоновых кислот
Низшие карбоновые кислоты — жидкости с резким запахом, хорошо растворимые в воде. По мере роста углеводородного радикала растворимость кислот падает, температуры кипения и плавления увеличиваются. Пальмитиновая и стеариновая кислоты — твёрдые вещества, нерастворимые в воде.

Основным способом получения карбоновых кислот служат реакции окисления. Исходные вещества в подобных синтезах — спирты и альдегиды:
Пищевую уксусную кислоту получают биотехнологическим путём — сбраживанием сахарсодержащих растворов при действии особых микроорганизмов.
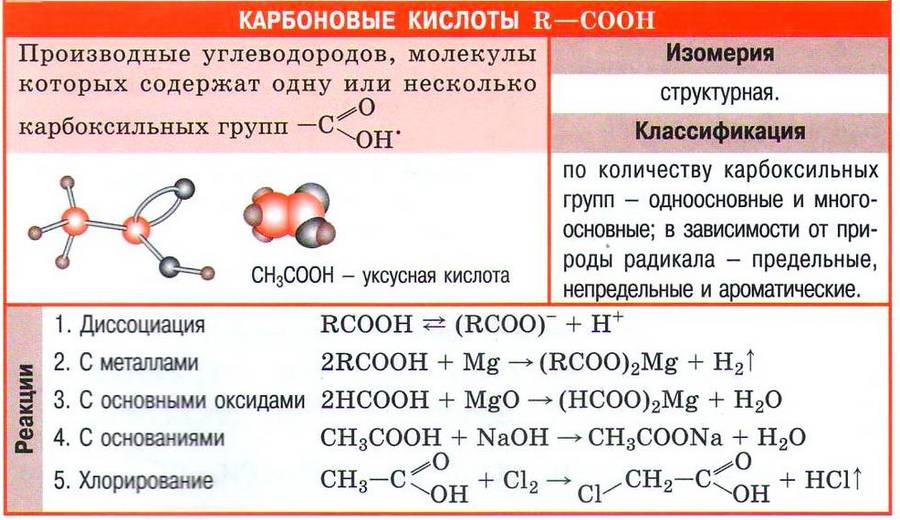
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Химические свойства карбоновых кислот

Следует учесть, что химические свойства карбоновых кислот, как и кислот неорганических, обусловлены их способностью диссоциировать с образованием катиона водорода:
Почему же в уравнении электролитической диссоциации соляной кислоты ставится знак равенства, а в аналогичном уравнении для уксусной кислоты — знак обратимости? Дело в том, что в отличие от соляной кислоты уксусная является слабой, распаду на ионы в водном растворе подвергается только небольшая часть её молекул.
Благодаря наличию в растворе катионов водорода карбоновые кислоты проявляют все характерные для кислот свойства: имеют кислый вкус, изменяют окраску индикаторов, реагируют с активными металлами, основными и амфотерными оксидами, основаниями, солями. Рассмотрим свойства карбоновых кислот на примере уксусной кислоты СН3СООН.

Уксусная кислота реагирует с активными металлами с образованием солей (ацетатов) и выделением водорода:

Оксиды металлов реагируют с уксусной кислотой с образованием соли металла и воды:

При взаимодействии уксусной кислоты со щелочами или нерастворимыми в воде основаниями также образуются соль и вода:

С солями уксусная кислота также взаимодействует. В этом случае, как и для протекания любых реакций ионного обмена, должно выполняться одно из условий: образование осадка, выделение газа или образование слабого электролита. Например, при реакции уксусной кислоты с карбонатом кальция выделяется углекислый газ:
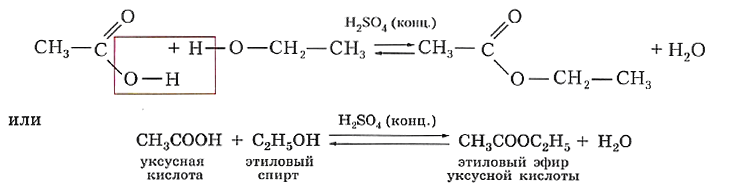
Одно из важнейших химических свойств карбоновых кислот вам уже знакомо. В присутствии концентрированной серной кислоты в качестве катализатора кислоты реагируют со спиртами, образуя сложные эфиры. Сама реакция вам уже знакома, это реакция этерификации. Так, в результате взаимодействия уксусной кислоты и этилового спирта образуется сложный эфир — этиловый эфир уксусной кислоты:
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты широко распространены в природе. Они содержатся во фруктах и ягодах, не только придавая им кисловатый вкус, но и предохраняя их от порчи и поражения вредителями.
Муравьиная кислота выделяется железами внутренней секреции муравьёв и некоторых видов медуз. Жжение листьев крапивы также обусловлено раздражением кожи муравьиной кислотой.
Области применения карбоновых кислот в промышленности, в технике и технологии, в быту также весьма обширны. Муравьиную кислоту применяют для протравливания текстиля и бумаги, обработки кожи, получения лекарственных средств, как консервант фруктовых соков и зелёных кормов. Она входит в состав средства для местной анестезии. Её также используют при крашении тканей и бумаги.
Уксусную кислоту используют как приправу к пище, как растворитель лаков, для производства лекарственных средств, например аспирина, для получения пластмасс, ядохимикатов, красителей. В продаже встречается уксусная эссенция — 70%-ный раствор уксусной кислоты. С кислотой такой концентрации необходимо обращаться очень осторожно! Её пары могут вызвать ожоги дыхательных путей, а употребление внутрь неразбавленной уксусной эссенции смертельно опасно. Хранить эссенцию нужно в месте, недоступном для детей и домашних животных.
Справочная таблица «Карбоновые кислоты»

Конспект урока по химии «Карбоновые кислоты». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Карбоновые кислоты и их химические свойства
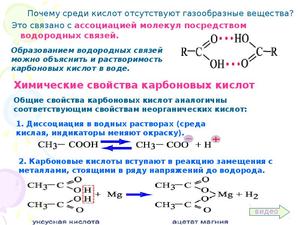
Химические соединения, основу которых составляет одна и более групп СООН, получили определение карбоновые кислоты.
В основу соединений входит группа СООН, имеющая два составляющих — карбонил и гидроксил. Группу атомов СООН называют карбоксильной группой (карбоксилом). Взаимодействие элементов обеспечивается сочетанием двух атомов кислорода и атома углерода.
Строение карбоновых кислот
Углеводородный радикал в одноосновных предельных кислотах соединяется с одной группой СООН. Общая формула карбоновых кислот выглядит так: R-COOH.
Строение карбоновой группы влияет на химические свойства.
Это интересно: анионы и катионы в химии, таблица растворимости.
Номенклатура
В названии карбоновых соединений сначала нумеруют атом углерода группы COOH. Количество карбоксильных групп обозначают приставками ди-; три-; тетра-.
Например,СН3-СН2-СООН — формула пропановой кислоты.
У карбоновых соединений существуют и привычные слуху названия: муравьиная, уксусная, лимонная…Все это названия карбоновых кислот.
Названия солей карбоновых соединений получаются из названий углеводорода с добавлением суффикса «-оат» (СООК)2- этандиот калия.
Классификация карбоновых кислот
Карбоновые кислоты классификация.
По характеру углеводорода:
- предельные;
- непредельные;
- ароматические.
По количеству групп СООН бывают:
- одноосновные (уксусная кислота);
- двуосновные (щавелевая кислота);
- многоосновные (лимонная кислота).
Предельные карбоновые кислоты — соединения, в которых радикал соединен с одним карбонилом.
Классификация карбоновых кислот разделяет их еще и по строению радикала, с которым связан карбонил. По этому признаку соединения бывают алифатические и алициклические.
Физические свойства
Рассмотрим карбоновые кислоты физические свойства.
Карбоновые соединения имеют различное число атомов углерода. В зависимости от этого числа физические свойства этих соединений различаются.
Соединения, имеющие в составе от одного до трех углеродных атомов, считаются низшими. Это жидкости без цвета с резким запахом. Низшие соединения с легкостью растворяются в воде.
Соединения, имеющие в составе от четырех до девяти углеродных атомов — маслянистые жидкости, имеющие неприятный запах.
Соединения, имеющие в составе более девяти углеродных атомов, считаются высшими и физические свойства этих соединений таковы: они являются твердыми веществами, их невозможно растворить в воде.
Температура кипения и плавления зависит от молекулярной массы вещества. Чем больше молекулярная масса, тем выше температура кипения. Для закипания и плавления нужна более высокая температура , чем спиртам.
Получение карбоновых кислот
Существует несколько способов получения карбоновых кислот.
- Получение карбоновых соединений при помощи окисления спиртов. Спирты взаимодействуют с оксидом хрома и разбавленной серной кислотой с добавлением ацетона или марганцовки.
- При помощи окисления альдегидов (оксид хрома вступает в реакцию с оксидом серебра).
- При помощи окисления алкенов. Используют смесь перманганата калия и периодат натрия в водном растворе в нейтральной среде.
- При помощи окисления алкилбензолов получают ароматические кислоты.
- При помощи гидролиза.
- При помощи карбоксилирования металлсодержащих соединений.
- С помощью синтеза ароматических соединений.
- Выделение из природных веществ (например, из жиров).
- Получение карбоновых соединений возможно при омылении или гидролизе эфиров и спирта.
- Получение карбоновых соединений происходит и из цианидов при помощи нагревания.
Химические свойства карбоновых кислот
При химических реакциях проявляются следующие свойства:

- диссоциация. Окрашивают лакмусовую бумажку в красный цвет, поскольку обладают кислыми свойствами;
- вступая в реакции с металлами, солями, оксидами и гидроксидами водород замещается на активные металлы;
- при реакциях со спиртами гидроксил замещается на остаток спирта. Таким образом получается сложный эфир;
- всегда происходит замещение водорода на галогены;
- при взаимодействии с основными оксидами образуются соль и вода;
- при взаимодействии с гидроксидами образуются соли и вода;
Применение карбоновых кислот
Карбоновые соединения распространены в природе.Поэтому их применяют во многих областях: в промышленности (легкой и тяжелой), в медицине и сельском хозяйстве, а также в пищевой промышленности и косметологии.
Ароматические в большом количестве содержатся в ягодах и фруктах.
В медицине используют молочную, винную и аскорбиновую кислоту. Молочную применяют в качестве прижигания, а винную — как легкое слабительное. Аскорбиновая укрепляет иммунитет.

В косметологии используются фруктовые и ароматические. Благодаря им клетки быстрее обновляются. Аромат цитрусовых способен оказать тонизирующее и успокаивающее действие на организм. Бензойная встречается в бальзамах и эфирных маслах, она хорошо растворяется в спирте.
Высокомолекулярные непредельные соединения встречаются в диетологии. Олеиновая в этой области наиболее распространена.
Полиненасыщенные с двойными связями (линолевая и другие) обладают биологической активностью. Их еще называют активными жирными кислотами. Они участвуют в обмене веществ, влияют на зрительную функцию и иммунитет, а также на нервную систему. Отсутствие этих веществ в пище или недостаточное их употребление затормаживает рост животных и оказывает негативное влияние на их репродуктивную функцию.
Сорбиновая получается из ягод рябины. Она является отличным консервантом.
Акриловая имеет едкий запах. Она применяется для получения стекла и синтетических волокон.
На основе реакции этирификации происходит синтез жира, который применяют при изготовлении мыла, а также моющих средств.
Муравьиная используется в медицине, в пчеловодстве, а также в качестве консервантов.
Уксусная — жидкость без цвета с резким запахом; легко смешивается с водой. Ее широко применяют в пищевой промышленности в качестве приправы. Также она используется при консервации. Еще она обладает свойствами растворителя. Поэтому широко применяется в производстве лаков и красок, при крашении. На ее основе изготавливают сырье для борьбы с насекомыми и сорняками.
Стеариновая и пальмитиновая (высшие одноосновные соединения) являются твердыми веществами и не растворяются в воде. Но их соли применяются в производстве мыла. Они делают брикеты мыла твердыми.
Поскольку соединения способны придавать однородность массам, то они широко используются в изготовлении лекарств.
Растения и животные также вырабатывают карбоновые соединения. Поэтому употреблять их внутрь безопасно. Главное, — соблюдать дозировку. Превышение дозы и концентрации ведет к ожогам и отравлениям.
Едкость соединений приносит пользу в металлургии, а также реставраторам и мебельщикам. Смеси на их основе позволяют выравнивать поверхности и очищать ржавчину.
Сложные эфиры, получаемые при реакции этерификации, нашли свое применение в парфюмерии. Они используются также в качестве компонентов лаков и красок, растворителей. А также как аромадобавки.
Предельные одноосновные карбоновые кислоты. Сложные эфиры.
По числу карбоксильных групп карбоновые кислоты делят на одноосновные (СН3СООН – уксусная или этановая кислота) и двухосновные (НООС-СООН – щавелевая кислота). Общая формула предельных одноосновных карбоновых кислот СnH2nO2.
Изомерия карбоновых кислот
Для предельных одноосновных карбоновых кислот характерна изомерия углеродного скелета, а также межклассовая изомерия со сложными эфирами.
CH3-CH(CH3)-COOH (2-метилпропановая кислота)
Строение карбоновых кислот
Карбоксильная группа –СООН состоит из карбонильной группы >C=O и гидроксильной группы –ОН, которые оказывают взаимное влияние друг на друга. Неподеленная пара электронов у кислорода в гидроксиле смещена в сторону карбонильного углерода, что ослабляет связь –ОН и увеличивает кислотные свойства.
Физические свойства карбоновых кислот
Низшие одноосновные кислоты – бесцветные жидкости с резким запахом, с водой смешиваются в любы отношениях. Высшие кислоты – твердые вещества, по мере увеличения углеводородного радикала растворимость в воде уменьшается. Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов.
Получение карбоновых кислот
Выделяют общие и специфические способы получения карбоновых кислот. Так, к общим способам получения кислот относят:
— гидролиз галогенангидридов карбоновых кислот
— гидролиз ангидридов карбоновых кислот
— гидролиз сложных жиров
— взаимодействие оксида углерода (IV) с магнийорганическими соединениями
— окислительное расщепление алкенов и алкинов
— окисление первичных спиртов
— окисление альдегидов и кетонов
К специфическим способам получения карбоновых кисло относят способы получения конкретных кислот, например, получение уксусной кислоты брожением этилового спирта.
Химические свойства карбоновых кислот
1. Кислотные свойства. Все карбоновые кислоты окрашивают лакмус в красный цвет. Это обусловлено диссоциацией кислот:
R-COOH ↔ R-COO — + H +
Карбоновые кислоты легко вступают в реакции с активными металлами, основными оксидами, основаниями и солями слабых кислот:
R-COOH + NaOH = RCOONa + H2O
Сильные минеральные кислоты вытесняют карбоновые кислоты из их солей:
CH3COONa + HCl = CH3COOH + NaCl
2. Образование функциональных производных. Путем замещения гидроксильной группы различными группами можно получать функциональные производные кислот общей формулы R-CO-X, где Х = группа, замещающая группу –ОН:
R-CO-OH + PCl5 = R-CO-Cl (хлорангидрид) + POCl3 + HCl
R-CO-OH + H-O-CO-R = R-CO-O-CO-R (ангидрид) +2HPO3
Все функциональные производные легко гидролизуются с образованием исходной кислоты.
3. Галогенирование. При действии галогенов на карбоновые кислоты в присутствии красного фосфора образуются α-галогензамещенные кислоты:
α-Галогензамещенные кислоты – более сильные кислоты, чем карбоновые.
Сложные эфиры
Сложные эфиры можно рассматривать как производные кислот, у которых атом водорода в карбоксильной группе замещен на углеводородный радикал.
Сложные эфиры получают по реакции этерификации – реакции взаимодействия кислот со спиртами:
Гидролиз под действием воды – обратимый процесс, для смещения равновесия вправо используют щелочи:
R-CO-OR’ + NaOH → R-CO-ONa + H-O-R’
Примеры решения задач
| Задание | Уксусную кислоту массой 5,40 г поместили в сосуд объемом 4,50 л и нагрели до температуры 200 °С. Давление паров при этом составило 43,7 кПа. Определите число молекул димера уксусной кислоты в газовой фазе. |
| Решение | В парах уксусная кислота находится частично в виде димеров, а частично в виде отдельных молекул: |
Исходное количество уксусной кислоты:
v(CH3COOH) = m/ M = 5,4 / 60 = 0,09 моль.
Пусть в реакцию димеризации вступило х моль СН3СООН, тогда образовалось х/2 моль димера (СН3СООН)2 и осталось (0,09 — х) моль СН3СООН. Общее количество веществ в газовой фазе равно:
v = PV / (RT) = 43,7 * 4,50 / (8,31 * 473) = 0,05 = х/2 + (0,09 – х),
откуда х = 0,08 моль.
Число молекул димера уксусной кислоты в газовой фазе равно:
N[(СН3СООН)2] = v * NA = 0,08 / 2 * 6,02*10 23 = 2,408*10 22 .
| Задание | Напишите схему превращений, с помощью которой из 3,3,3-трихлорпропена можно получить 3-гидроксипропановую кислоту. Укажите условия проведения реакций. |
| Решение | Хлороводород присоединяется к 3,3,3-трихлорпропену против правила Марковникова за счет -/-эффекта группы ССl3: |
Гидролиз образующегося тетрахлорпроизводного водным раствором КОН дает (после подкисления) гидроксикислоту:





