Анализ смеси катионов и анионов
Для быстрого определения ограниченного числа содержащихся в смеси катионов или анионов удобнее использовать дробный анализ. Полный анализ многокомпонентной смеси можно провести значительно быстрее, если применить систематический анализ. Для удобства проведения систематического анализа все ионы разделяют на группы, используя сходства или различия свойств ионов в отношении действия групповых реактивов. Например, согласно наиболее удобной в качественном анализе кислотно-основной классификации все катионы делятся на шесть групп по их отношению к серной и соляной кислотам, к едким щелочам и гидроокиси аммония (таблица 1).
Первая группа объединяет катионы NH4 + , K + , Na + , которые не осаждаются ни минеральными кислотами, ни щелочами, т.е. не имеют группового реактива. Катионы второй группы Ag + , Hg + и Pb 2+ осаждаются соляной кислотой. Третью группу образуют катионы Ba 2+ , Sr 2+ и Cа 2+ , которые осаждаются серной кислотой. В четвертую группу объединяются катионы Zn 2+ , Al 3+ , Сr 3+ , Sn 4+ , As 3+ и As 5+ , не выпадающие в осадок при добавлении избытка щёлочи. Пятую группу составляют катионы Fe 2+ , Fe 3+ , Mg 2+ , Мn 2+ , Bi 3+ , Sb 3+ , Sb 5+ . Все они осаждаются раствором щёлочи. Шестая группа катионов Hg 2+ , Cu 2+ , Сd 2+ , Со 2+ и Ni 2+ образует гидроокиси, растворимые в избытке раствора гидроокиси аммония с образованием растворимых аммиакатов.
В основу классификации анионов положено различие в растворимости солей бария, серебра, кальция, свинца и др. Общепринятой классификации не существует.
По наиболее распространенной классификации все анионы делятся на три аналитические группы (таблица 2).
Таблица 1 − Разделение катионов на группы по кислотно─щелочной классификации
| Груп- па | Катионы | Групповой реагент | Получаемые соединения | Групповая характеристика |
| K + , Na + , NH4 + | Нет | Хлориды, сульфаты и гидроокиси растворимы в воде | ||
| Ag + , Pb 2+ , Hg2 2+ | 2н раствор HCl | Осадок AgCl и т.п. | Хлориды не растворимы в воде | |
| Ba 2+ , Sr 2+ , Ca 2+ | 2н раствор H2SO4 | Осадок BaSO4 и т.п. | Сульфаты не растворимы в воде | |
| Zn 2+ ,As 5+ Sn 4+ , Al 3+ , Sn 2+ , Cr 3+ | Избыток 4 н раствора NaOH или KOH | Раствор ZnO2 2- AlO2 – и т.д. | Гидроокиси растворимы в избытке раствора NaOH и KOH | |
| Mg 2+ , Mn 2+ , Bi 3+ , Fe 2+ , Fe 3+ , Sb 3+ , Sb 5+ , | Избыток 25% – ного раствора NH4OH | Mg(OH) 2, Mn(OH) 2 и т.д. | Гидроокиси не растворимы в избытке аммиака | |
| Сu 2+ , Hg 2+ , Cd 2+ , Co 2+ , Ni 2+ | Избыток 25% – ного раствора NH4OH | [Cu(NH3)4] 3+ , [Hg(NH3)4] 3+ и т.д. | Аммиакаты растворимы в избытке раствора аммиака |
В большинстве случаев анионы открываются дробным методом. Групповые реактивы используются не для отделения группы, а для обнаружения присутствия анионов групп.
Таблица 2 − Классификация анионов
| Груп- па | Анионы | Групповой реак- тив | Характеристика группы |
| SO4 2- , SO3 2- , CO3 2- , PO4 3- , SiO3 2- | BaCl2 в нейтральном или слабощелочном растворе | Соли бария нерастворимы в воде | |
| Cl – , Br – , J – , S 2- | AgNO3 в присутствии HNO3 | Соли серебра нерастворимы в воде и в разбавленной азотной кислоте | |
| NO3 – , NO2 – , CH3COO – | Группового реагента нет | Соли бария и серебра растворимы в воде |
При выполнение качественного обнаружения катионов и анионов в определяемом объекте в начале проводят предварительные испытания (определяют некоторые катионы и анионы дробным методом). Затем проводят их разделение на соответствующие группы с помощью групповых реактивов. После этого проводят анализ каждой группы катионов или анионов с целью определения отдельных ионов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Лабораторная работа «Качественное определение катионов и анионов» (6 часов)
Описание катионов и анионов в химии, их примеры, таблица растворимости

Средняя оценка: 4.7
Всего получено оценок: 97.
Средняя оценка: 4.7
Всего получено оценок: 97.
Частица, в которой содержится разное число протонов и электронов, называется ионом. Если количество протонов больше, ион приобретает положительный заряд и становится катионом. Ионы с отрицательным зарядом (преобладают электроны) называются анионами.
Общее описание
Впервые в химии понятие «ион» появилось в 1834 году благодаря экспериментам Майкла Фарадея. Учёный изучал электропроводность водных растворов кислот, солей, щелочей. Он предположил, что возможность проводить электричество обусловлена движением в растворе заряженных частиц – ионов.
Молекулы способны распадаться на ионы – атомы с недостатком или избытком электроном. Процесс распада называется электролитической диссоциацией, а образованный раствор или расплав – электролитом. Если опустить в раствор электролита электрод, катионы начнут двигаться к катоду – отрицательному полюсу, анионы – к аноду – положительному полюсу. Этим объясняется электропроводность электролитов.
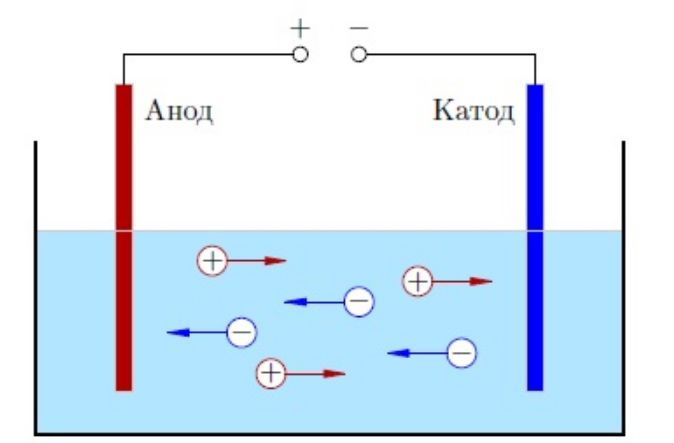
Рис. 1. Движение ионов под действием электрода.
В растворах или в расплавах ионы образуются под действием молекул воды или высокой температуры.
Строение
Ионы состоят из ядра и электронов, движущихся вокруг. Ядро образуют положительно заряженные частицы (протоны) и нейтральные частицы (нейтроны). Количество протонов совпадает с порядковым номером элемента. Количество нейтронов равно значению разницы между относительной атомной массой и количеством протонов.
Электроны располагаются на энергетических уровнях. Количество уровней совпадает с периодом, в котором находится элемент. На внешнем энергетическом уровне находятся валентные электроны, которые могут взаимодействовать с другими атомами. При отдаче валентных электронов атом превращается в катион, при присоединении дополнительного электрона становится анионом.
Например, если к атому хлора присоединить ещё один электрон он станет отрицательно заряженным ионом – анионом. А если у атома натрия отнять один электрон, он станет положительно заряженным ионом – катионом, т.к. количество протонов станет больше, чем отрицательных электронов.
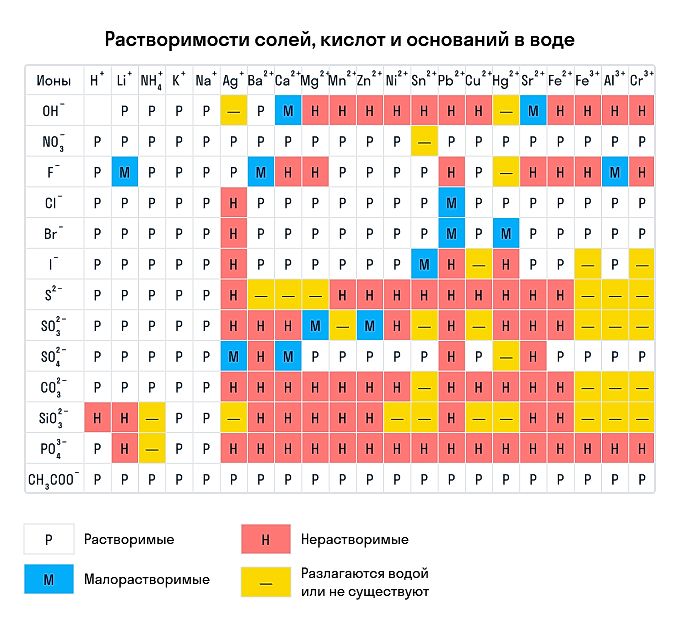
Катионы в уравнениях отмечаются плюсом, а анионы – минусом. Например, Fe 2+ , Al 3+ , Na + , F – , Cl – . Цифра означает, сколько электронов отдал или принял атом, став ионом, т.е. показывает степень окисления. Количество катионов или анионов можно посмотреть по таблице растворимости веществ.

Рис. 2. Таблица растворимости.
Классификация
Ионы делятся на две группы:
- простые или моноатомные – содержат одно ядро, т.е. состоят из одного атома вещества;
- сложные или полиатомные – содержат минимум два ядра, т.е. состоят из двух и более атомов вещества.
К простым ионам относятся катионы и анионы металлов и неметаллов – Na + , Mg 2+ , Cl – . Сложные ионы образуются при присоединении иона к нейтральным молекулам вещества. Например:
Катионами являются ионы металлов, водорода, аммония и некоторых других веществ. Анионами являются гидроксид-ион (OH – ), ионы кислотных остатков, неметаллов и других веществ.
Некоторые атомы могут становиться катионами или анионами в зависимости от реакции.
Также выделяют ион-радикалы – свободные заряженные частицы, способные присоединять атомы или присоединяться к атомам других веществ. В зависимости от заряда делятся на китионы-радикалы и анионы-радикалы.
Ионная связь – класс соединения ионов. Ионная связь возникает в результате электростатического притяжения анионов и катионов. При этом атом с большей электроотрицательностью притягивает атом с меньшей электроотрицательностью. Ионная связь возникает преимущественно между ионами металлов и неметаллов. Металл всегда отдаёт электроны, т.е. является восстановителем.
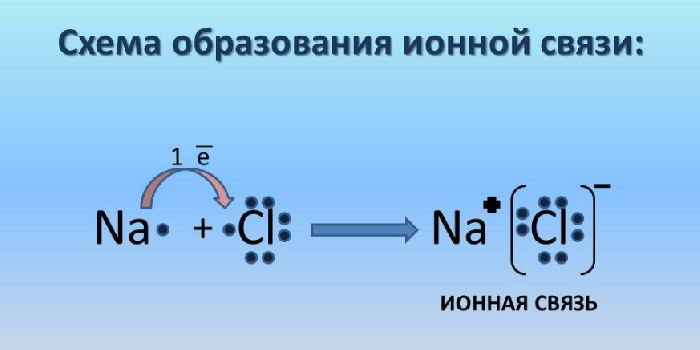
Рис. 3. Схема ионной связи.
Что мы узнали?
Из темы урока узнали, что такое ионы. Атом становится ионом при отщеплении или присоединении электронов. Если электронов становится меньше, то атом приобретает положительный заряд за счёт преобладания протонов и становится катионом. При увеличении количества отрицательно заряженных электронов атом становится анионом. Ионы способны передавать электричество и обязательно присутствуют в электролитах. Между ионами возникает ионная связь за счёт электростатического притяжения отрицательных и положительно заряженных частиц.
Качественные реакции

Как отличить одно сложное вещество от другого, если они внешне выглядят одинаково? Для этого есть качественные реакции, которые также называют аналитическими. Они сопровождаются каким-либо внешним эффектом, по которому и опознают состав вещества. В этом материале мы рассмотрим качественные реакции органических и неорганических соединений.
О чем эта статья:
Что такое качественная реакция
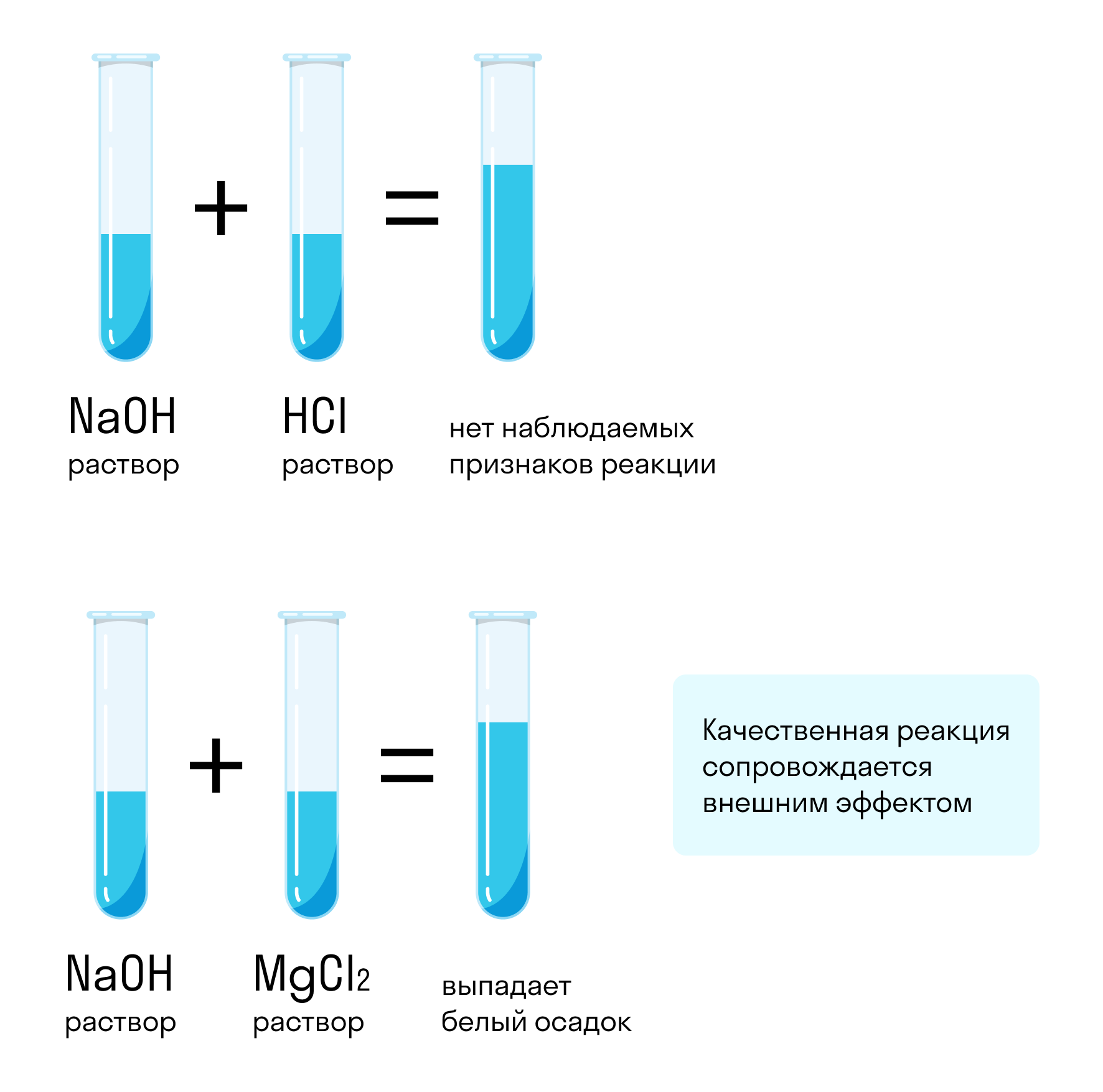
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
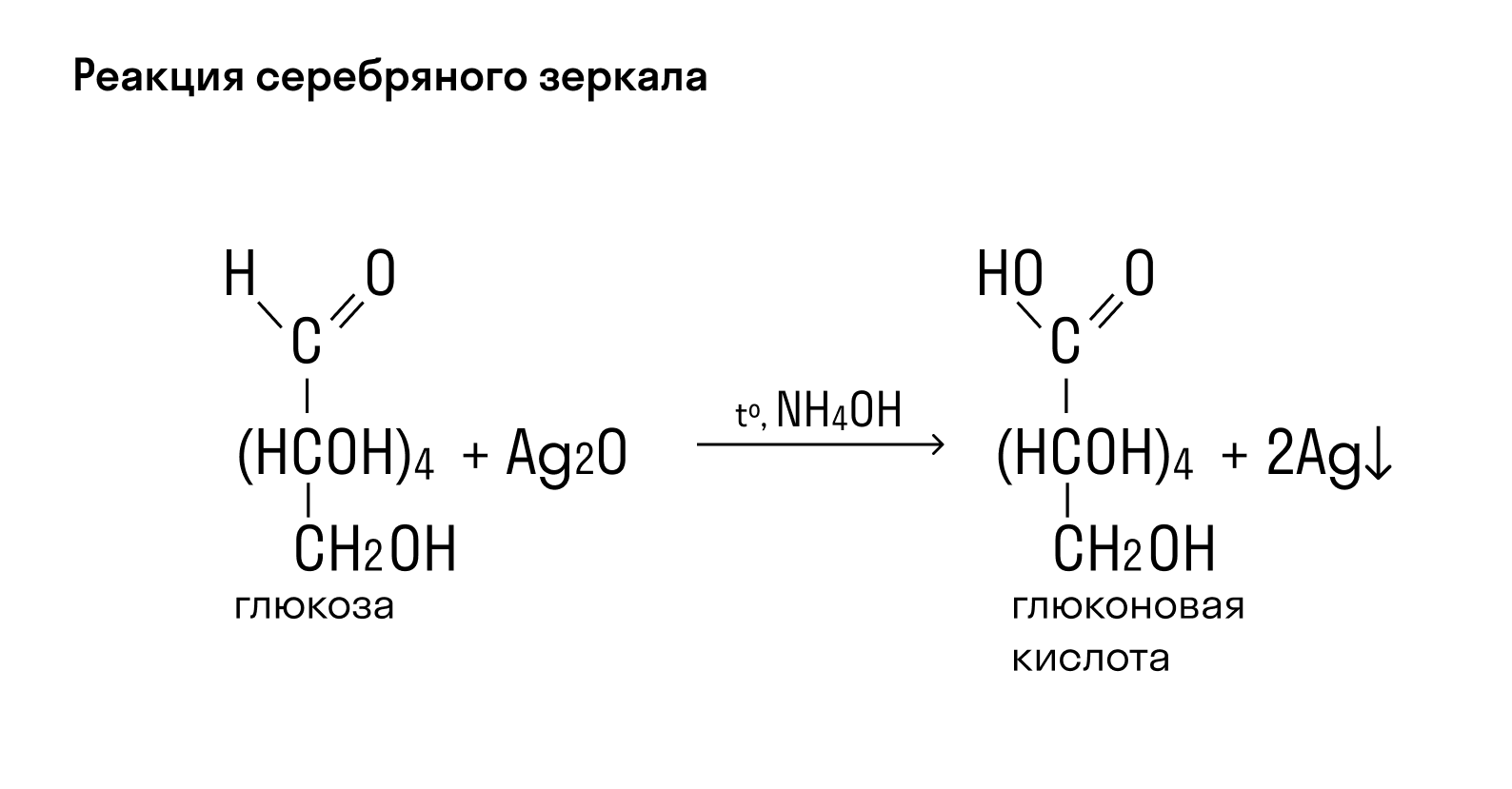
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
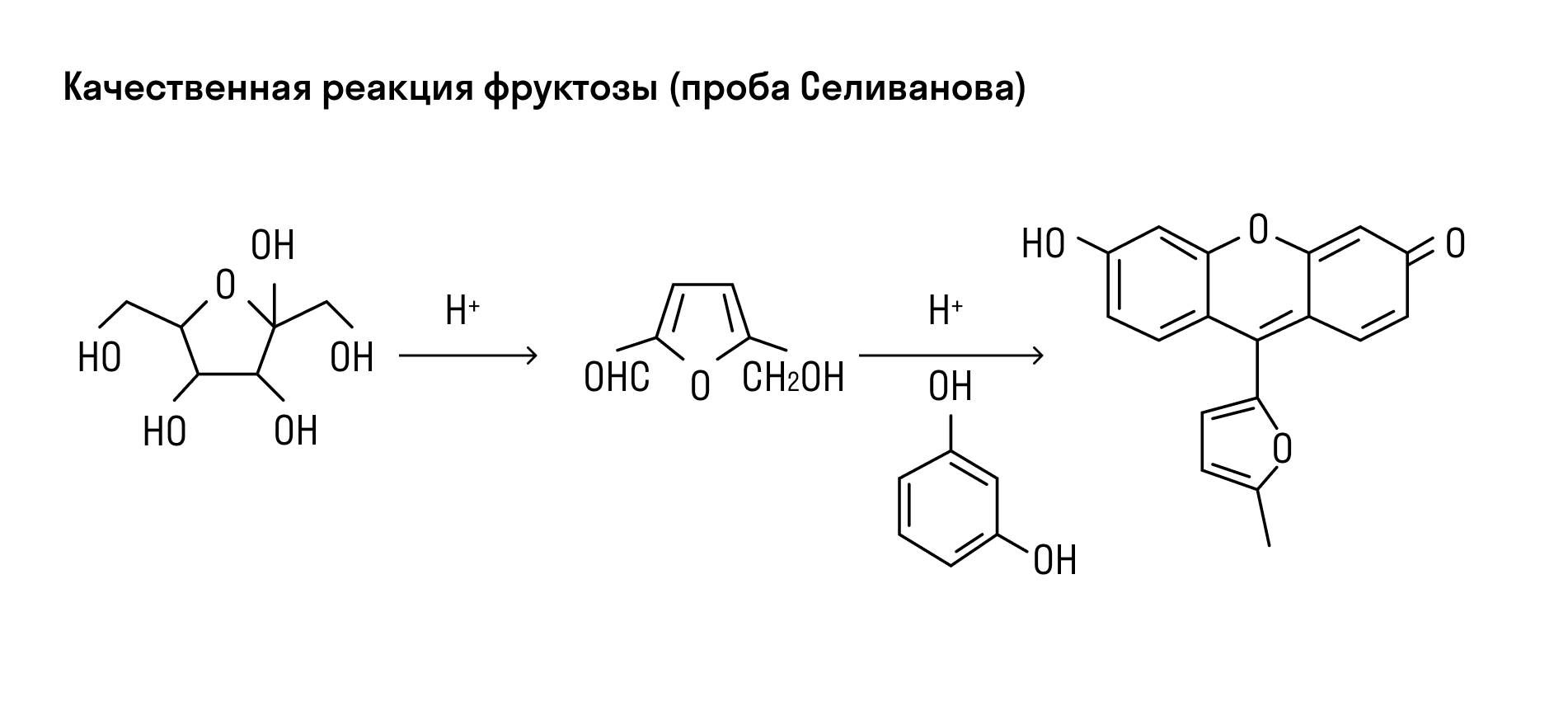
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Аналитическая классификация анионов по группам (Таблица)
Справочные таблицы, в которых дана сероводородная аналитическая классификация анионов 1-3 групп, качественные реакциии и групповые реагенты, а также аналитические сигналы на анионы.
Таблица аналитическая классификация анионов
Данная аналитическая классификация анионов основанна на растворимости солей бария Ba 2+ и серебра Ag + , и включает в себя 3 аналитические группы анионов.
Анионы, относящиеся к данной группе
Соли бария, нерастворимые в воде
Хлорид бария в нейтральной среде
Соли серебра, нерастворимые ни в воде, ни в разбавленной азотной кислоте
Нитрат серебра в присутствии азотной кислоты

Таблица аналитические сигналы на анионы первой группы
в нейтральной среде
молочнобелый осадок, нерастворимый в кислотах
в нейтральной среде
Выделение углекислого газа CO 2
белый студенистый Н 2 SiO 3
Хлорид аммония NH 4 Cl при нагревании
молибденовая жидкость при кипячении
желтый крист.осадок фосфомолибдата аммония
Таблица аналитические сигналы на анионы второй группы
AgNO 3 в присутствии HNO 3
AgCl белый творожистый растворим в избытке NH 4 ОН
AgBr желто-белый, частично растворим в избытке NH 4 ОН, хорошо растворим в Na 2 S 2 O 3
AgI светложелтый, растворим в Na 2 S 2 O 3 и в большом иодида калия
Хлорная вода в кислой среде
Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет
Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет
диоксид марганца MnO 2 в кислой среде
Свободный хлор, практически не окрашивает бензол-толуол
Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет
Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет
Таблица аналитические сигналы на анионы третьей группы
Анионы
металлический алюминий или цинк ( Al , Zn ) в щелочной среде
выделяется аммиак NH3
металлическая медь (Cu)
выделяются буро-желтые пары диоксида азота ( NO 2)
раствор окрашивается в синий цвет
раствор окрашивается в синий цвет
сильные кислоты ( HCl , H2SO4)
выделяются желто- бурые пары окислов азота
перманганат калия (KMnO4)
раствор перманганата калия обесцвечивается
Таблица аналитическая классификация анионов на окислительно-восстановительных свойствах
Эта аналитическая классификация анионов основанна на их окислительно-восстановительных свойствах. Она также включает три аналитические группы анионов.
Результат действия реагента
в сернокислой среде
Выделение иода I2
в сернокислой среде
Обесцвечивание раствора KMnO4
3. Индифферентные анионы

Поделитесь ссылкой с друзьями:
Похожие таблицы
- Аналитическая классификация катионов по группам (Таблица)
- Качественные реакции на анионы (Таблица)
Комментарии:
| Подписываемся на обновления! | ||
infotables.ru © 2014 – 2021. Копирование материала с сайта возможно только при наличие активной индексируемой ссылки на infotables.ru
Информация, размещенная на сайте, предоставлена в целях ознакомления. Владельцы сайта infotables.ru не несут ответственности за риски, связанные с использованием информации, полученной с этого cайта.
Качественый химический анализ катионов и анионов

Можно с уверенностью сказать, что химия – это, по сути, прикладная физика. И хотя данные науки занимаются изучением совершенно разных вопросов, но законы взаимодействия вещества в химии никто не отменял.
Как было описано выше, электроны имеют свои строго определенные места – орбитали. Когда атомы образуют какое-либо вещество, то они, сливаясь в группу, также «делятся» своими электронами с соседями. И хотя молекула остается электрически нейтральной, одна ее часть может представлять собой анион, а другая катион.
Это интересно! Что такое алканы: строение и химические свойства
За примером далеко ходить не требуется. Для наглядности можно взять всем известную соляную кислоту, она же хлороводород – HCL. Водород в данном случае будет обладать положительным зарядом. Хлор же в данном соединении является остатком и называется хлоридом – тут он имеет заряд отрицательный.
На заметку! Довольно легко выяснить какими свойствами обладают те или иные анионы.
Таблица растворимости покажет, какое вещество хорошо растворяется, а какое сразу же вступает во взаимодействие с водой.
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона также выделит 13 эВ.
Теория электролитической растворимости

Во время растворения электролиты диссоциируют на имеющие разный заряд ионы: положительные и отрицательные. При воздействии тока положительные ионы направляются в сторону катода, тогда как отрицательные в сторону анода. Катод – положительный заряд, анод – отрицательный. В итоге происходит движение ионов.
Одновременно с диссоциацией проходит противоположный процесс – соединение ионов в молекулы. Кислоты – это такие электролиты, при распаде которых образуется катион – ион водорода. Основания – анионы – это гидроксид ионы. Щелочи – это основания, которые растворяются в воде. Электролиты, которые способны образовывать и катионы и анионы, называются амфотерными.
Анионы и катионы
Анионы связываются с катионами (положительно заряженными ионами) посредством химических связей, известных как «ионные связи». Так обстоит дело, например, с поваренной солью (хлорид натрия, NaCl), в которой анионы хлорида (Cl — ) связаны с катионами натрия (Na + ).
Катионы
Это частицы, носящие положительный заряд. Могут иметь разную величину заряда, например: Са2+ — двузарядный катион, Na+ — однозарядный катион. Мигрируют к отрицательному катоду в электрическом поле.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням, каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома хлора, пять электронов на 3p-подуровне, энергия сродства хлора — 3.61 эВ, энергия ионизации — 13 эВ. У натрия на последнем подуровне один электрон, энергия сродства — 0,78 эВ, потенциал ионизации — 0,49 эВ, поэтому вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и в результате получится смесь ионов Na + и Cl — .
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная конфигурация — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 , вероятнее всего, такой элемент может либо отдать, либо принять один электрон. У 27го элемента электронная конфигурация выглядит так: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 , у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст 1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния — это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять окислительно-восстановительные реакции!
Растворимость веществ
Растворимость — способность вещества образовывать однородные системы, смешиваясь с другими веществами. Эти системы называются растворами.
Сильное взаимодействие между молекулами или ионами вещества и молекулами растворителя приводит к разрушению кристаллической решетки растворимого вещества, например, поваренной соли. При этом частицы растворенного вещества образуют неустойчивые агрегаты с молекулами растворителя. Если растворителем является вода, эти агрегаты называются гидратами, при их образовании выделяется энергия. В случае водных растворов эта энергия называется энергией гидратации. Если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решетки, то растворение будет сопровождаться нагреванием, а если меньше — охлаждением раствора.
В разбавленных растворах плохо растворимых солей устанавливается равновесие между твердым кристаллическим осадком и ионами в растворе: часть ионов из кристаллов непрерывно переходит в раствор, и столько же — из раствора в осадок. Если перемножить концентрации ионов в растворе, то получится постоянная величина. Ее название — произведение растворимости, часто она сокращенно обозначается ПР.
Для B a S O 4 П Р = [ В а 2 + ] × [ S O 4 2 – ] .
Квадратные скобки означают, что в выражении указана равновесная концентрация иона в моль/л.
Если при растворении 1 моль вещества образуется несколько молей катионов или анионов, их концентрации возводятся в соответствующую степень.
Для P b I 2 ; П Р = ; l b r a c k P b 2 + r b r a c k ; t i m e s l e f t [ I – r i g h t ] 2 .
Зависимость от природы растворенного вещества и растворителя
Растворитель — не просто инертная среда, позволяющая молекулам и ионам свободно двигаться и сталкиваться между собой: порой он может активно вмешиваться в ход химической реакции, например, уменьшить концентрацию ионов. В ходе реакции с молекулами растворителя они могут превратиться в газообразные соединения, которые улетучатся из раствора. Также под влиянием растворителя ионы могут связываться в малодиссоциированное соединение. В качестве примера можно привести малорастворимые гидроксиды металлов, которые растворяются в кислотах.
Химические реакции в неводных растворах, например, с участием солей в жидком аммиаке часто протекают совсем иначе, нежели в воде, поскольку растворимость одних и тех же веществ в разных жидкостях различается. Значительно меняются при смене растворителя и кислотно-основные свойства веществ.
Если соединить расплавленные металлы, то получившаяся жидкость тоже будет считаться раствором. Введение второго компонента снижает температуру плавления всей смеси.
Но если разница атомных радиусов двух металлов невелика, меньше 15%, а температуры плавления этих металлов различаются не более чем на 27%, то при затвердевании жидкого сплава образуется так называемый твердый раствор. В нем атомы обоих металлов, как и в жидкости, будут относительно равномерно перемешаны, а температура плавления этого сплава будет зависеть от соотношения компонентов. Электропроводность металлических сплавов обычно меньше, чем у каждого из металлов по отдельности, твердость при этом больше.
Влияние природы растворенного вещества и растворителя на растворимость выражается эмпирическим правилом «подобное растворяется в подобном», что в переводе на язык современной химии означает, что полярные вещества хорошо растворяются в полярных растворителях, а неполярные — в неполярных. Например, вода является полярным растворителем, в ней хорошо растворяется серная кислота с полярными молекулами H 2 S O 4 , но неполярный водород Н 2 растворяется плохо.
Что оказывает влияние на процесс
Растворимость (коэффициент растворимости) — максимальная масса вещества в граммах, которая может раствориться в 100 г воды при данных условиях (температуре и давлении).
Растворимость газов в жидкости определяется температурой и давлением. На растворимость жидких и твердых веществ в большинстве случаев может влиять только температура.
Воздействие температуры и давления
Растворимость большинства газов увеличивается при увеличении давления. При снижении температуры растворимость большинства газов увеличивается.
В случае нагревания жидких и твердых веществ их растворимость чаще всего увеличивается. Изменение давления обычно на их растворимость не влияет, но может уменьшать ее на тысячные массовых долей при увеличении давления до 20–30 бар. Это доказано уравнением Планка-ван Леара, отражающим зависимость растворимости, давления и мольных объемов веществ. Тем не менее, существуют аномальные системы, примером которых могут служить твердые углеводороды, растворимые в нефти при высоких температуре и давлении.
При охлаждении из насыщенного раствора (содержащего максимально возможное при данных условиях количество растворенного вещества) выпадает осадок. Этот процесс называется кристаллизацией. Массу осадка можно высчитать с использованием кривых растворимости (они отражают зависимость растворимости от температуры).
Таблица растворимости, как правильно пользоваться
Чтобы воспользоваться таблицей, нужно найти пересечение столбца, в котором указан анион вещества, и строки, в которой указан катион. По символу, записанному в клетке на пересечении, определяют качественную характеристику растворимости вещества.
Первая из приведенных таблиц позволяет узнать, будет ли вещество растворяться в воде. Вторая, более полная, позволяет узнать растворимость в кислотах. Во второй таблице буква Н обозначает нерастворимость в воде, Н К — полную нерастворимость, Р К — растворимость исключительно в неорганических кислотах. Г — соединения, которые гидролизуются.
Примеры задач на растворимость
Вычислите растворимость A g 2 C r O 4 в моль/л при условии, что в 100 мл раствора содержание вещества — 0,002156 г.
Вычислим растворимость A g 2 C r O 4 , моль/л.
Пусть x г соли содержится в 1000 мл раствора, тогда x = 1000 × 0 , 002156 / 100 = 0 , 02156 г / л .
Молярная масса хромата серебра — 331 , 73 г / м о л ь .
Растворимость равна [ A g 2 C r O 4 ] = 0 , 02156 / 331 , 73 м о л ь / л = 6 , 5 × 10 – 5 м о л ь / л .
Вычислите растворимость оксалата кальция C a C 2 O 4 в граммах на литр. П Р — 2 , 57 × 10 – 9 .
Уравнения химического равновесия в растворе:
C a C 2 O 4 ↓ ⇆ C a 2 + + C 2 O 4 2 –
П Р C a C 2 O 4 = [ C а 2 + ] × [ C 2 O 4 2 – ] .
Пусть x моль/л — растворимость C a C 2 O 4 . При диссоциации мы получим x моль C а 2 + и x моль C 2 O 4 2 – .





