Постулаты и правило квантования Бора
Бор построил свою теорию атома на двух основных постулатах.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют некоторые стационарные состояния, не изменяющиеся во времени без внешних воздействий. Этим состояниям соответствует определенная энергия, в них атом не излучает электромагнитных волн (квантов энергии).
Второй постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое им испускается или поглощается один квант энергии е = Лю, равный по величине разности энергий стационарных состояний: е = ДЕ.
Оба постулата находятся в противоречии с классической механикой, согласно которой энергия движущегося электрона (она- то и определяет энергию стационарного состояния атома в целом) может быть любой, а также и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Второй постулат также противоречит электродинамике еще и потому, что частота излучения, по Бору, определяется только изменением энергии атома и никак не зависит от характера движения электрона.
Бором также введено правило квантования момента импульса Ь„ х электрона в атоме, в виде соотношения между скоростью движения электрона и радиусом орбиты:
1 Рассмотренная в подразделе 1.2.9 (формула (1.93)) физическая величина, имеющая размерность [импульс х длина] = [энергия х время], называется также действием — поэтому правило квантования Бора называют еще и правилом квантования действия.

где п = 1,2, 3. Целое число п получило в разработанной впоследствии квантовой физике атома название главного квантового числа.
Согласно правилу квантования Бора момент импульса Ьп электрона в атоме может принимать только дискретные (квантованные) значения, равные по величине целому числу п постоянных Планка й.
Состояние с п = 1 (и соответствующим моментом импульса и энергией) называется основным состоянием атома, все другие (си = и’>1) — возбужденные состояния.
Правило квантования позволяет определить некоторые характеристики атомной системы количественно и, как потом выяснилось, с высокой точностью.
Так, применяя второй закон Ньютона к электрону в атоме водорода (относительный заряд Z = 1 ядра, он же атомный номер в периодической системе элементов) или в водородоподобном атоме (это любой атом — положительно заряженный ион с зарядом ядра Z > 1, лишенный всех электронов, кроме одного — одноэлектронный атом), т.е., приравнивая силу, действующую на движущийся со скоростью о по круговой орбите электрон, силе его кулоновского взаимодействия с ядром (с зарядом Z|e|), получаем

где те = — 9,11 • 10 _31 кгие = 1,60- 10 -19 Кл — масса и заряд электрона соответственно; гп — радиус круговой орбиты электрона — боровский радиус.
Скорость и электрона и радиус г„ стационарной орбиты связаны правилом квантования Бора (7.65), используя которое совместно с (7.66) получаем, что радиусы стационарных круговых орбит определяются выражением

Радиусы орбит возрастают пропорционально и 2 и обратно пропорциональны Z.

При Z= 1 для первой (п = 1) орбиты в атоме водорода (первый боровский радиус)
Полная энергия водородоподобного атома Е„, равная сумме кинетической энергии Т электрона и потенциальной энергии U его кулоновского взаимодействия с ядром (ядро считается неподвижным), также может быть получена из правила квантования Бора последовательным рассуждением:

Далее из (7.66) следует, что

Подставляя в (7.69) г„ из выражения (7.67), полученного с использованием правила квантования Бора для энергии водородоподобного атома

т.е. дискретный неэквидистантный (с не равноотстоящими по шкале энергий уровнями) энергетический спектр, показанный на рис. 7.48 (диаграмма Гротриана). На рисунке также показана энергия ионизации
Е, = — IЕ, I =- ” , , атома Я, т.е. минимальная энергия, которую нуж-
но сообщить атому водорода для того, чтобы оторвать электрон от ядра. Для водородоподобного атома эта энергия z = Z 2 Et.
Теперь, зная энергетические состояния атома (7.70), можно, используя второй постулат Бора, рассчитать частоты со и длины волн X спектральных линий, возникающих при переходе атома из одного стационарного состояния с целочисленным п в другое — с т ф п (при переходах между состояниями п -* т, когда т > п происходит излучение энергии, если же т *, , = 1,0973731 • 10 7 м _| — постоянная Ридберга (употребляется
также ее представление в виде R’= Rc = 3,2931193 • 10 15 с -1 ) и называется спектральной сериальной формулой.
При п = 1, т > 2 в спектре испускания атома водорода (Z = 1) наблюдается серия Лаймана (ультрафиолетовая область спектра), при п = 2, т > 3 — серия Бальмера (видимая область), п = 3, т > 4 — серия Пашёна (инфракрасный спектр), п = 4, 5, 6. — серии Брикета, Пфунда, Хемфри и далее, в убывающем частотном ряду, другие спектральные серии.
Теория Бора позволила также понять происхождение рентгеновских спектров (см. далее подраздел 8.6.4), являющихся, подобно оптическим спектрам, характеристикой внутриатомной структуры вещества. Идеи Бора позволили понять природу закона, которому подчиняются рентгеновские спектры атомов — закона Мозли (см. далее формулу (8.98)). Подобно оптическим, рентгеновские спектры также образуют серии, общая структура которых одинакова для всех химических элементов. Из выражения для частот, полученного с помощью теории Бора, следует, что частоты линий рентгеновских спектров должны быть примерно пропорциональны квадрату атомного номера элемента. Таким образом, закон Мозли нашел свое объяснение, и теория атома Бора оказалась применимой в разных областях шкалы электромагнитных волн.
Прекрасное согласие боровской теории атома водорода с экспериментом послужило веским аргументом в пользу ее справедливости. Однако попытки применить эту теорию к более сложным атомным системам не увенчались успехом.
Постулаты и формулы Бора для атома водорода, а также правило квантования Бора кратко
«Физика – 11 класс»
Квантовые постулаты Бора. Модель атома водорода по Бору
Выход из крайне затруднительного положения в теории атома был найден в 1913 г. датским физиком Нильсом Бором на пути дальнейшего развития квантовых представлений о процессах в природе.

Эйнштейн оценивал проделанную Бором работу «как высшую музыкальность в области мысли», всегда его поражавшую.
Основываясь на разрозненных опытных фактах, Бор благодаря гениальной интуиции правильно предугадал путь развития теории атома.
Постулаты Бора
Последовательной теории атома Бор, однако, не разработал.
Он в виде постулатов сформулировал основные положения новой теории.
Причем и законы классической физики не отвергались им безоговорочно.
Новые постулаты, скорее, налагали лишь некоторые ограничения на рассматриваемые классической физикой движения.
Успех теории Бора был тем не менее поразительным, и всем ученым стало ясно, что Бор нашел правильный путь развития теории.
Этот путь привел впоследствии к созданию стройной теории движения микрочастиц — квантовой механики.
Первый постулат Бора
Cуществуют особые, станционарные состояния атома, находясь в которых атом не излучает энергию, при этом электроны в атоме движутся с укорением.
Каждому стационарному состоянию соответствует определенная энергия Еn.
Bторой постулат Бора
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией Еn. Энергия излученного фотона равна разности энергий стационарных состояний:
Отсюда частоту излучения можно выразить так:

Согласно теории Бора энергия электрона в атоме водорода, находящегося на n-м энергетическом уровне, равна:

При поглощении света атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией.
Второй постулат, также как и первый, противоречит электродинамике Максвелла, так как согласно этому постулату частота излучения света свидетельствует не об особенностях движения электрона, а лишь об изменении энергии атома.
Свои постулаты Бор применил для построения теории простейшей атомной системы — атома водорода.
Основная задача состояла в нахождении частот электромагнитных волн, излучаемых водородом.
Эти частоты можно найти на основе второго постулата и правила определения стационарных значений энергии атома.
Это правило (правило квантования) Бору опять-таки пришлось постулировать.
Модель атома водорода по Бору
Используя законы механики Ньютона и правило квантования, на основе которого определяются возможные стационарные состояния атома, Бор смог вычислить радиусы орбит электрона и энергии стационарных состояний атома.
Минимальный радиус орбиты определяет размеры атома.
На рисунке значения энергий стационарных состояний (в электрон- вольтах 1 ) отложены на вертикальной оси.
В атомной физике энергию принято выражать в электронвольтах (сокращенно эВ).
1 эВ равен энергии, приобретаемой электроном при прохождении им разности потенциалов 1 В: 1 эВ = 1,6 • 10 -19 Дж.

Теория Бора приводит к количественному согласию с экспериментом для значений этих частот.
Все частоты излучений атома водорода составляют в своей совокупности ряд серий, каждая из которых образуется при переходах атома в одно из энергетических состояний со всех верхних энергетических состояний (состояний с большей энергией).
Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней образуют серию Бальмера.
На рисунке эти переходы изображены стрелками.
Данная серия названа по имени швейцарского учителя И. Бальмера, который еще в 1885 г. на основе экспериментальных данных получил простую формулу для определения частот видимой части спектра водорода.
Поглощение света
Поглощение света — процесс, обратный излучению.
Атом, поглощая свет, переходит из низших энергетических состояний в высшие.
При этом он поглощает излучение той же самой частоты, которую излучает, переходя из высших энергетических состояний в низшие.
На основе двух постулатов и правила квантования Бор определил радиус атома водорода и энергии стационарных состояний атома.
Это позволило вычислить частоты излучаемых и поглощаемых атомом электромагнитных волн.
Трудности теории Бора. Квантовая механика
Наибольший успех теория Бора имела в применении к атому водорода, для которого оказалось возможным построить количественную теорию спектра.
Однако разработать количественную теорию для следующего за водородом атома гелия на основе боровских представлений не удалось.
Относительно атома гелия и более сложных атомов теория Бора позволяла делать лишь качественные (хотя и очень важные) заключения.
Это и неудивительно.
Ведь теория Бора является половинчатой, внутренне противоречивой.
С одной стороны, при разработке теории атома водорода использовались привычные законы механики Ньютона и давно известный закон Кулона, а с другой — вводились квантовые постулаты, никак не связанные с механикой Ньютона и электродинамикой Максвелла.
Введение в физику квантовых представлений требовало радикальной переработки как механики, так и электродинамики.
Эта переработка была осуществлена в начале второй четверти XX в., когда были созданы новые физические теории: квантовая механика и квантовая электродинамика.
Постулаты Бора оказались совершенно правильными.
Но они рассматривались уже не как постулаты, а как следствия основных принципов этих теорий.
Правило же квантования Бора, как выяснилось, применимо далеко не всегда.
Представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось весьма условным.
На самом деле движение электрона в атоме имеет очень мало общего с движением планет по орбитам.
Если бы атом водорода в наинизшем его энергетическом состоянии можно было сфотографировать с большой выдержкой, то мы увидели бы облако с переменной плотностью.
Большую часть времени электрон находится на определенном расстоянии от ядра.
Это расстояние можно принять за грубое подобие радиуса орбиты.
Фотография атома совсем не походила бы на привычный рисунок Солнечной системы, а скорее напоминала бы расплывчатое пятно, полученное при фотографировании бабочки, порхающей около фонаря.
В настоящее время с помощью квантовой механики можно ответить практически на любой вопрос, относящийся к строению и свойствам электронных оболочек атомов.
Источник: «Физика – 11 класс», учебник Мякишев, Буховцев, Чаругин
Атомная физика. Физика, учебник для 11 класса – Класс!ная физика
Атом Бора.
Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев.
Темы кодификатора ЕГЭ: постулаты Бора.
Планетарная модель атома, успешно истолковав результаты опытов по рассеянию -частиц, в свою очередь столкнулась с очень серьёзными трудностями.
Как мы знаем, любой заряд, движущийся с ускорением, излучает электромагнитные волны. Это – неоспоримый факт классической электродинамики Максвелла, подтверждаемый многочисленными наблюдениями.
Нам также хорошо известно, что электромагнитные волны несут энергию. Стало быть, ускоренно движущийся заряд, излучая, теряет энергию, которая этим излучением уносится.
А теперь давайте возьмём произвольный электрон в планетарной модели. Он двигается вокруг ядра по замкнутой орбите, так что направление его скорости постоянно меняется. Следовательно, электрон всё время имеет некоторое ускорение (например, при равномерном движении по окружности это будет центростремительное ускорение), и поэтому должен непрерывно излучать электромагнитные волны. Расходуя свою энергию на излучение, электрон будет постепенно приближаться к ядру; в конце концов, исчерпав запас своей энергии полностью, электрон упадёт на ядро.
Если исходить из того, что механика Ньютона и электродинамика Максвелла работают внутри атома, и провести соответствующие вычисления, то получается весьма озадачивающий результат: расход энергии электрона на излучение (с последующим падением электрона на ядро) потребует совсем малого времени – порядка секунды. За это время атом должен полностью “коллапсировать” и прекратить своё существование.
Таким образом, классическая физика предрекает неустойчивость атомов, устроенных согласно планетарной модели. Этот вывод находится в глубоком противоречии с опытом: ведь на самом деле ничего такого не наблюдается. Предметы нашего мира вполне устойчивы и не коллапсируют на глазах! Атом может сколь угодно долго пребывать в невозбуждённом состоянии, не излучая при этом электромагнитные волны.
Постулаты Бора.
Оставалось признать, что внутри атомов перестают действовать известные законы классической физики. Микромир подчиняется совсем другим законам.
Первый прорыв в познании законов микромира принадлежит великому датскому физику Нильсу Бору. Он предложил три постулата, резко расходящиеся с механикой и электродинамикой, но тем не менее позволяющих правильно описать простейший из атомов – атом водорода.
Классическая физика хорошо описывает непрерывные процессы – движение материальной точки, изменение состояния идеального газа, распространение электромагнитных волн. . . Энергия объекта, подчиняющегося механике или электродинамике, в принципе может принимать любые значения. Однако линейчатые спектры указывают на дискретность процессов, происходящих внутри атомов. Эта дискретность должна фигурировать в законах новой теории.
Первый постулат Бора. Всякий атом (и вообще, всякая атомная система) может находиться не во всех состояниях с любым, наперёд заданным значением энергии. Возможен лишь дискретный набор избранных состояний, называемых стационарными, в которых энергия атома принимает значения Находясь в стационарном состоянии, атом не излучает электромагнитные волны.
Как видим, первый постулат Бора вопиющим образом противоречит классической физике: налагается запрет на любые значения энергии, кроме избранного прерывистого набора, и признаётся, что электроны, вроде бы движущиеся ускоренно, на самом деле не излучают.
Выглядит фантастически, не правда ли? Однако в том же 1913 году, когда Бор предложил свои постулаты, существование стационарных состояний было подтверждено экспериментально – в специально поставленном опыте немецких физиков Франка и Герца. Таким образом, стационарные состояния – это не выдумка, а объективная реальность.
Значения разрешённого набора называются уровнями энергии атома. Что происходит при переходе с одного уровня энергии на другой?
Второй постулат Бора. Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией , то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией
Эта же формула работает и при поглощении света: в результате столкновения с фотоном атом переходит из состояния в состояние с большей энергией , а фотон при этом исчезает.
Для примера на рис. 1 показано излучение фотона при переходе атома с энергетического уровня на уровень . Переход заключается в том, что электрон “соскакивает” с одной орбиты на другую, расположенную ближе к ядру.

Рис. 1. Излучение фотона атомом
Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми.
В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии разрешённого дискретного набора ; соответственно, набор этих частот также получается дискретным. Вот почему спектр излучения атомов состоит из отдельно расположенных резких ярких линий.
Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия которого в точности равна разности каких-то двух разрешённых значений энергии и . Переходя в состояние с более высокой энергией , атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние . Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии.
Качественного объяснения характера атомных спектров, однако, недостаточно. Хотелось бы иметь теорию, позволяющую вычислить частоты наблюдаемых спектров. Бору удалось это сделать в самом простом случае – для атома водорода.
Атом водорода.
Атом водорода состоит из ядра с зарядом , которое называется протоном, и одного электрона с зарядом (через обозначена абсолютная величина заряда электрона). При построении своей теории атома водорода Бор сделал три дополнительных предположения.
1. Прежде всего, мы ограничиваемся рассмотрением только круговых орбит электрона. Таким образом, электрон движется вокруг протона по окружности радиуса с постоянной по модулю скоростью (рис. 2 ).

Рис. 2. Модель атома водорода
2. Величина , равная произведению импульса электрона на радиус орбиты , называется моментом импульса электрона. В каких единицах измеряется момент импульса?
Это в точности размерность постоянной Планка! Именно здесь Бор увидел появление дискретности, необходимой для квантового описания атома водорода.
Правило квантования (третий постулат Бора). Момент импульса электрона может принимать лишь дискретный набор значений, кратных “перечёркнутой” постоянной Планка:
3. Выше мы говорили, что классическая физика перестаёт работать внутри атома. Так оно в действительности и есть, но вопреки этому мы предполагаем, что электрон притягивается к протону с силой, вычисляемой по закону Кулона, а движение электрона подчиняется второму закону Ньютона:
Эти три предположения позволяют довольно просто получить формулы для уровней энергии атома водорода. Переписываем соотношение (3) в виде:
Из правила квантования (2) выражаем :
и подставляем это в (4) :
Отсюда получаем формулу для допустимых радиусов орбит электрона:
Теперь перейдём к нахождению энергии электрона. Потенциальная энергия кулоновского взаимодействия электрона с ядром равна:
(Она отрицательна, так как отсчитывается от бесконечно удалённой точки, в которой достигает максимального значения.)
Полная энергия электрона равна сумме его кинетической и потенциальной энергий:
Вместо подставим правую часть выражения (4) :
Полная энергия, как видим, отрицательна. Если на радиус орбиты никаких ограничений не накладывается, как это имеет место в классической физике, то энергия может принимать любые по модулю значения. Но согласно (5) существует лишь дискретный набор возможных значений радиуса; подставляя их в (6) , получаем соответствующий набор допустимых значений энергии атома водорода:
Основное состояние атома водорода – это состояние с наименьшей энергией . В основном состоянии атом может находиться неограниченно долго. Вычисление даёт:
Мы видим, что если атом находится в основном состоянии, то для выбивания электрона нужно сообщить атому энергию, равную как минимум 13,6 эВ. Эта величина носит название энергии ионизации атома водорода.
По формуле (5) легко вычислить радиус орбиты основного состояния:
То есть, диаметр атома оказывается равным как раз см – величине, известной из опыта. Таким образом, теория Бора впервые смогла объяснить размер атома!
Кроме того, в рамках теории Бора удаётся получить формулы для вычисления частот (или длин волн) спектра атома водорода. Так, согласно второму постулату Бора и формуле (7) имеем:
На практике чаще имеют дело с длинами волн. Учитывая, что , формулу (8) можно переписать так:
Константа м называется постоянной Ридберга. Теория Бора даёт значение этой постоянной, очень хорошо согласующееся с экспериментом.
Длины волн спектра атома водорода образуют серии, характеризующиеся фиксированным значением в формуле (9) . Все длины волн данной серии излучаются при переходах на уровень с вышележащих энергетических уровней .
Переходы в основное состояние:
образуют серию Лаймана. Длины волн этой серии описываются формулой (9) при :
Линии серии Лаймана лежат в ультрафиолетовом диапазоне.
Переходы на второй уровень:
образуют серию Бальмера. Длины волн этой серии подчиняются формуле (9) при :
Первые четыре линии серии Бальмера лежат в видимом диапазоне (рис. 3 ), остальные – в ультрафиолетовом.

Рис. 3. Видимый спектр атома водорода (серия Бальмера)
Переходы на третий уровень:
образуют серию Пашена.Длины волн этой серии описываются формулой (9) при :
Все линии серии Пашена лежат в инфракрасном диапазоне.
Имеются ещё три “именованных” серии: это серия Брэккета (переходы на уровень), серия Пфунда (переходы на уровень ) и серия Хэмпфри (переходы на уровень ). Все линии этих серий лежат в далёкой инфракрасной области.
Достоинства и недостатки теории Бора.
О достоинствах модели атома водорода, предложенной Бором, мы так или иначе уже сказали. Резюмируем их.
-Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы.
Для микромира характерно квантование – дискретность изменения величин, описывающих состояние объекта. В качестве меры квантования, как показала теория Бора, может выступать постоянная Планка , которая является универсальной константой и играет фундаментальную роль во всей физике микромира (а не только в явлениях излучения и поглощения света).
-Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира.
-В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы.
Однако теория Бора, разумеется, не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков.
-Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы – второй закон Ньютона и закон Кулона – используются для записи уравнения движения электрона по круговой орбите.
-Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы.
-Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой , построенной десятилетием позже – в 1920-х годах.
Постулаты и формулы Бора для атома водорода, а также правило квантования Бора кратко
§3 Постулаты Бора
К 1913 г. имелись три экспериментальных факта, которые не находили объяснения в рамках классической физики:
- Эмпирические закономерности линейчатого спектра атома водорода, выраженные в формуле Бальмера – Ридберга.
- Ядерная модель атома Резерфорда.
- Квантовый характер излучения и поглощения света (тепловое излучение и фотоэффект).
Для возможности разрешения возникших затруднений Н. Бор (датский ученый) сформулировал три постулата для водорода и водородоподобных атомов – ядром с зарядом Ze и один электрон движется вокруг ядра.
I – й постулат – постулат стационарных состояний:
В системе существуют некоторые стационарные состояния, не изменяющиеся во времени без внешних воздействий. В этих состояниях атом не излучает света.

II –й постулат – правило квантования орбит:
В стационарном состоянии атома электрон, двигаясь по круговой орбите с ускорением, не излучает света, должен иметь дискретные (квантованные) значения момента импульса

III – й постулат – правило орбит:
Излучение испускается или поглощается в виде светового кванта энергии при переходе электрона из одного стационарного состояния в другое.
Величина светового кванта равна разности энергий стационарных состояний, между которыми совершается переход электрона

,

n m – поглощение фотона.
Набор возможных дискретных частот

Квантовых переходов и определяют линейчатый спектр атома.
§4 Опыты Франка и Герца
Первый и третий постулаты Бора были экспериментально подтверждены в опытах Франка и Герца (немецкие ученые) в 1913 г.

Вакуумная трубка, заполненная парами ртути (давление р ~13 Па) содержала катод (К), две сетки (С1 и С2) и анод (А). Электроны, испускаемые катодом ускорялись разностью потенциалов, приложенной между К и С1. Между сеткой С2 и А приложен небольшой задерживающий потенциал 0,5 В. Электроны, ускоренные в области, где испытывают соударения с атомами ртути. Электроны, которые имеют после соударения достаточную энергию для преодоления задерживающего потенциала в области 3 (по рисунку), достигают анода. При неупругих соударениях электронов с атомами ртути последние могут возбуждаться. Согласно теории Бора, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. (Основное состояние n = 1, возбужденное – n = 2, 3, 4,…) Поэтому, если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний.
Из опыта следует, что при увеличении ускоряющего потенциала до 4,86 В анодный ток возрастает монотонно. Пройдя при U = 4,86 В через максимум, анодный ток резко падает. Затем опять возрастает при изменении U = 4,86 ÷ 2·4,86 В. При U = 2·4,86 В падает и затем опять возрастает и т.д.

Ближайшим к основному состоянию атома ртути является возбужденное состояние, отстоящее от основного на 4,86 эВ. Пока разность потенциалов U С1-К < 4,86 В электроны испытывают упругие столкновения, и под действием поля летят к А. При U С1-К = 4,86 В энергия электронов поглощается парами ртути, и энергии электронов не хватает на преодоление задерживающего потенциала и т.д.
Атом ртути, переходя в основное состояние, испускает свет с λ = 255 нм (УФ), который и был обнаружен в опыте. Таким образом, опыт Франка и Герца подтвердил I и III – й постулаты Бора.
§5 Спектр атома водорода по Бору
При движении электрона по орбите сила Кулона является центростремительной. Тогда

По II – му постулату Бора




Радиус первой боровской орбиты равен
Внутренняя энергия атома равна сумме кинетической и потенциальной энергии





Подставив в формулу выражение для r , получим разрешенные значения энергии:

(1)
где знак минус означает, что электрон находится в связанном состоянии. Из формулы (1) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n . Целое число n в (1), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n =1 является основным состоянием. Состояние с n > 1 называется возбужденным. Энергетический уровень, соответствующий основному состоянию, называется основным, все остальные – возбужденными.


Ионизация атома – отрыв электрона от атома. Энергия ионизации атома водорода равна 13,6 эВ.

Согласно II – му постулату Бора при переходе атома водорода из стационарного состояния n в стационарное состояние m ( n > m ) испускается квант с энергией


– формула Бальмера – Ридберга,

где – постоянная Ридберга.
Теория Бора внутренне противоречива: применяет законы классической физики, а основывается на квантовых постулатах. Теория Бора не может объяснить спектр атома гелия.
Квантовые постулаты Бора. Модель атома водорода по Бору

Посмотрев этот видеоурок, ребята познакомятся с теорией Бора, созданной для объяснения стабильности атома. Мы также рассмотрим особенности модели атома водорода по Бору. А также познакомимся с условием квантования круговых орбит электронов.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока “Квантовые постулаты Бора. Модель атома водорода по Бору”
На прошлом уроке мы с вами рассматривали опыты Эрнеста Резерфорда по рассеянию альфа-частиц, которые позволили учёному создать ядерную (или планетарную) модель атома.

Однако при всей своей убедительности планетарная модель атома оказалась внутренне противоречивой. По законам электродинамики движущийся ускоренно заряд излучает электромагнитные волны. Следовательно, атом должен непрерывно излучать электромагнитные волны. Излучение же связано с уменьшением энергии электрона в поле ядра. Следствием этого должно явиться уменьшение скорости движения и частоты вращения электронов вокруг ядра. Если частота непрерывно изменяется, то спектр излучения атома должен быть сплошным. Уменьшение скорости электрона должно привести к тому, что электрон будет двигаться по спирали к ядру и в течение короткого времени упадёт на него, то есть в этой модели атом должен быть неустойчивым.
Это находится в полном противоречии с экспериментальными фактами, которые свидетельствуют о том, что:
· атом является достаточно устойчивой системой;
· атом излучает электромагнитные волны лишь при определенных условиях, а не непрерывно;
· а спектры излучения атомов являются линейчатыми.
Эти противоречия возникли потому, что к электронам в атомах применяли законы классической физики, а, как мы уже с вами знаем, в микромире действуют свои законы, отличные от законов макромира. Первым признал невозможность применения законов классической физики к атомам датский учёный Нильс Бор. Он ввёл элементы квантовой теории в модель атома Резерфорда и в 1913 году создал неклассическую теорию атома. В её основе лежала идея связать в единое целое три результата, полученные в физике к тому времени.
Для решения этой задачи Бор, сохраняя классический подход к описанию поведения электрона в атоме, выдвинул два предположения, которые мы называем постулатами Бора. Сразу же отметим, что физический смысл этих постулатов не только не мог быть объяснён в классической физике, но, более того, находился в глубоком противоречии с классическим описанием движения электрона в атоме.
В современном виде постулаты Бора формулируются следующим образом.
Первый постулат Бора (постулат стационарных состояний):
атом может находиться в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия. Находясь в стационарном состоянии, атом не излучает и не поглощает энергию.
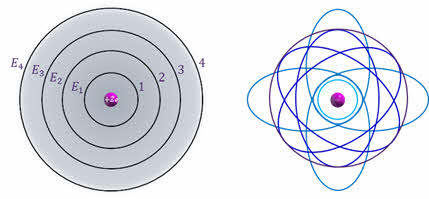
Стационарные состояния можно пронумеровать, присвоив им порядковые номера, причём каждому состоянию соответствует определенное дискретное значение энергии. Согласно модели Бора стационарным состояниям атома соответствуют определенные (разрешённые) орбиты, по которым электроны движутся вокруг ядра. При движении по этим орбитам электроны не излучают электромагнитные волны.
Первый постулат противоречит нашим представлениям о движении в классической механике, так как мы знаем, что скорость тел изменяется постепенно и может принимать любые значения. Бор вводит понятие квантования скоростей и орбит электрона: скорости и радиусы орбит могут изменяться не непрерывно, а имеют только определённый дискретный набор значений.
Второй постулат Бора ещё называют правилом частот:
атом может переходить из одного стационарного состояния в другое. При этом переходе может испускаться или поглощаться квант электромагнитного излучения, частота которого определяется разностью энергий атома в данных состояниях:

Из формулы следует, что если электрон переходит с более низкой орбиты на более высокую, то он поглощает квант энергии. Если же наоборот, переход осуществляется с более высокой на более низкую орбиту, то электрон излучает квант энергии.
Состояние атома, которому соответствует наименьшая энергия, называется основным. А состояния, которым соответствуют большие значения энергии, — возбуждёнными. В основном энергетическом состоянии атом может находиться неограниченно долго, а в остальных стационарных состояниях порядка 10 –6 с. Это так называемое время жизни атома в возбуждённом состоянии.
Как следует из второго постулата Бора, частота излучения атома не связана с частотой вращения электрона по орбите, она определяется разностью значений энергии атома в начальном и конечном состояниях. Переход атома из одного стационарного состояния в другое сопровождается электромагнитным излучением определённой длины волны:

Для объяснения же эмпирических закономерностей в спектре атома водорода эти два постулата были дополнены правилом квантования орбит, которое иногда называют третьим постулатом Бора:
в стационарном состоянии атома электрон, движущийся по круговой орбите, должен иметь квантованные (дискретные) значения момента импульса, которые удовлетворяют условию:

В записанной формуле m — это масса электрона, υ — его скорость на n-й орбите, rn — радиус стационарной орбиты, а n = 1, 2, 3, . — это номер орбиты электрона.
Таким образом, постулаты Бора основывались на трёх экспериментальных предпосылках — результатах исследования атомных спектров, квантовой теории излучения, развитой Планком и Эйнштейном, и ядерной (планетарной) модели атома Резерфорда.
Исходя из этих постулатов и используя планетарную модель строения атома, Нильс Бор разработал количественную теорию атома водорода. Он рассчитал радиусы стационарных орбит электрона в атоме водорода и вычислил соответствующие им значения энергии.

Проделаем это и мы. Итак, согласно классическим представлениям, электрон движется вокруг ядра под действием кулоновской силы, которая сообщает ему центростремительное ускорение:

Согласно второму закону Ньютона, сила притяжения со стороны ядра должна определяться произведением массы электрона и его центростремительного ускорения:

С другой стороны, как упоминалось выше, сила притяжения к ядру есть не что иное, как сила Кулона, определяемая, в данном случае, отношением квадрата заряда электрона к квадрату радиуса орбиты:

Перепишем второй закон Ньютона с учётом наших рассуждений и представим полученное выражение так, как это показано на экране:

Теперь запишем условие квантования орбит и выразим из него скорость электрона:

Далее найдём выражение, для определения радиусов разрешённых стационарных орбит электрона в атоме водорода:

Как видно из формулы, радиусы стационарных устойчивых орбит возрастают пропорционально квадратам номеров орбит:

Для примера давайте с вами определим радиус первой боровской орбиты электрона.

Этот радиус, ближайший к атомному ядру, определяет размер атома водорода в основном состоянии.
Так как радиус орбиты может принимать только дискретные (квантованные) значения, то и энергия атома в различных стационарных состояниях может также принимать только дискретные значения.
Итак, очевидно, что энергия электрона в атоме водорода равна сумме его кинетической энергии при движении по круговой орбите и потенциальной энергии в электростатическом поле ядра:

(поскольку взаимодействуют частицы, имеющие заряды противоположных знаков, то между ними действует сила кулоновского притяжения и потенциальная энергия их взаимодействия отрицательна).
Подставим в эту формулу значения скорости электрона и радиуса орбиты:
Проведя все необходимые математические вычисления и преобразования, получим формулу для определения энергии электрона, находящегося на n-й орбите:

Из этой формулы видно, что энергия атома водорода квантована и определяется только номером орбиты.
Давайте рассчитаем значение энергии электрона в атоме водорода на первой боровской орбите.

Для наглядного представления возможных энергетических состояний атомов используются энергетические диаграммы, на которых каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем.
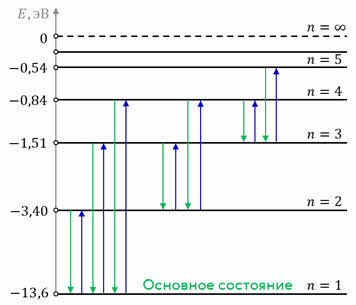
Ниже всех на диаграмме располагается энергетический уровень, соответствующий основному состоянию (состояния с минимальной энергией). Энергетические уровни возбуждённых состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбуждённого и основного состояний. Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на диаграмме. Направление перехода обозначается стрелкой.
Из диаграммы видно, что чем электрон дальше от ядра, тем на меньшую величину отличаются соседние уровни энергии, то есть густота энергетических уровней растёт. Квантовые скачки при этом уменьшаются, вследствие чего переходы между стационарными состояниями атома всё больше и больше становятся «похожими» на непрерывное изменение энергии, то есть энергия становится почти непрерывной величиной, как и в классической теории.
Если попытаться выразить частоту излучения атома водорода при его переходе с одного энергетического уровня на другой, то окажется, что полученное выражение полностью совпадает с эмпирической формулой Бальмера — Ридберга:

А вычисленная постоянная Ридберга по этой формуле показывает хорошее совпадение с найденной из эксперимента.
В 1922 году Нильсу Бору была присуждена Нобелевская премия «за заслуги в исследовании строения атомов и излучения», так как его исследования фактически положили начало новому этапу развития спектроскопии, которая из эмпирической науки превратилась в эффективный метод изучения атомной структуры. Спустя пол века по этому поводу Бор скажет: «Я увидел путь рождения спектров!»
Итак, что же дала нам модель атома водорода по Бору. Во-первых, она позволила вычислить энергию ионизации атома водорода, хорошо согласующуюся с экспериментом. А во-вторых, дала мощный толчок к объяснению закономерностей периодической системы химических элементов Менделеева. Согласно модели атома Бора электроны движутся по определенным орбитам, образующим различные группы — электронные оболочки. Структура электронных оболочек определяет химические свойства элементов, которые периодически повторяются по мере заполнения оболочек электронами. Это позволило «предсказывать» свойства ранее неизвестных элементов. Так, например, был открыт элемент га́фний, по своим свойствам аналогичный цирконию. Модель атома Бора также объяснила основные закономерности спектра атома водорода, хотя частично сохранила классический характер, поскольку в ней предполагалось, что электроны движутся по орбитам вокруг ядра.

Оставалось, однако, неясным, от чего зависит интенсивность излучения тех или иных частот. Без ответа остался вопрос, почему совершаются те или иные переходы. Но самым серьёзным недостатком модели атома Бора была невозможность построить теорию более сложных атомов (даже атома гелия — одного из простейших атомов, непосредственно следующего за атомом водорода). Но модель атома Бора явилась переходным этапом на пути к созданию современной теории атомных и ядерных явлений — квантовой механики.
Квантовые постулаты и основные положения теории Бора кратко

Квантовые постулаты Бора, объясняющие до этого не понимаемые физиками процессы, происходящие в атомах, стали фундаментом, на котором впоследствии выросла квантовая физика. В основу квантовой теории, разработанной Нильсом Бором, входят три постулата, сформулированные им в результате экспериментов либо наблюдений за поведением атомов различных веществ, правило квантования, выведенное на основе изучения атома водорода, и несколько формул, математически объясняющих постулаты Бора.
Видео поможет вам лучше понять теорию, если во время чтения статьи возникнут вопросы. Посмотреть видео о правилах теории отца квантовой физики вы можете, перейдя по ссылкам:
- https://www.youtube.com/watch?v=b0jRlO768nw;
- https://vk.com/video290915595_171732857.
Постулаты, входящие в квантовую теорию Бора
Первое правило
Первое правило гласит, что энергия En в системах, образованных из атомов, может существовать, только если эти атомы находятся в специализированных или, иными словами, квантовых состояниях. В других случаях атом не отдаёт свою энергию в окружающую его среду.
Это правило, выведенное учёным, абсолютно противоречит знаниям, накопленным классической механикой. Согласно аксиомам классической механики, любые атомы либо электроны, которые в настоящее время движутся, обладают энергией, и эта энергия может быть любого рода.
Кроме того, основной вывод из первого постулата одного из отцов квантовой физики в корне противоречит знаниям в области электромагнетизма, полученным Максвеллом в девятнадцатом веке, поскольку допускает возможность движения молекулярных частиц без излучения в окружающее пространство электромагнитных импульсов.
Второе правило теории

Оно гласит, что свет, который излучает атом, является результатом его перехода из состояния, во время которого он обладал большей энергией Ek, в состояние, в котором он обладает уже меньшей энергией En. Формула, рассчитывающая количество энергии, которую излучает в окружающее пространство фотон, представляет собой разность Ek — En.
Исходя из этой формулы, легко рассчитать какова будет частота света, излучаемого фотоном. Для этого нужно разделить разность Ek — En на постоянную Планка.
Второе правило теории Бора предусматривает, что возможен обратный процесс, т. е. атом может вернуться в состояние, где он хранит в себе больший запас энергии, чем был у него ранее, если перед этим он поглотит некоторое количество энергии света.
Третий постулат Бора
Суть его состоит в том, что электрон в атоме либо атом в молекуле переходят с одной орбиты на другую и во время этого либо испускают, либо поглощают энергию. Эта энергия выделяется из них так называемыми квантами или порциями, которые наука может измерить и вычислить.
Третье правило, обнаруженное Бором, было изучено другими известными физиками и подтверждено в результате эксперимента, проведённого учёными Франком и Герцем.
Третий постулат сыграл значительную роль в развитии оптики, поскольку доказал, что атомы испускают только те спектры света, которые способны также и поглотить.
Атом водорода и правило квантования
Для того чтобы разработать модель атома простейшего из известных в настоящее время элементов, водорода, Бор постулировал правило квантования или, иными словами, закономерность, согласно которой определяются уровни энергии электрона в зависимости от его стационарных значений, занимаемых им на орбите.
Отсюда следует, что в зависимости от того, на какой орбите находится электрон в атоме или атом в молекуле определяется коэффициент обладаемой ими энергии.
При помощи правила квантования, опираясь на выведенные Ньютоном законы механики, Нильс Бор смог вычислить значение минимального возможного радиуса орбиты электрона в атоме, а также значения энергии, которые имеют атомы и электроны, находясь в стационарных состояниях.
Значение постулатов и их влияние на научный мир
Несмотря на то что некоторые предположения и мнения, высказанные Бором, в дальнейшем оказались неправильными и ошибочными, за что его нещадно критиковали коллеги по научному цеху и в том числе сам Альберт Эйнштейн, тем не менее его постулаты сыграли важную роль в физике:

- Они стали на тот момент единственным логическим и выверенным объяснением того, что происходит в нашем мире на микроуровне, как протекают в нём процессы и каким закономерностям они подчиняются.
- Правило квантования и постулаты помогли учёным прояснить некоторые замеченные ими закономерности рентгеновского спектра излучения, а также подтвердить истинность таблицы Менделеева с точки зрения физической науки.
- Научное знание, которое Бор передал науке, позволило следующему поколению физиков разрешить вопрос, касающийся деления ядра атома, понять, как можно измерить скорость деления ядра и, самое главное, понять, как можно контролировать этот процесс.





