Ковалентная химическая связь: полярная, неполярная, схемы образования и примеры молекул
I. Сущность ковалентной связи
Ковалентная связь – это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
II. Ковалентная неполярная химическая связь
Ковалентная неполярная связь (КНС) – образуют атомы одного и того же химического элемента – неметалла (Например, H2, O2, О3).
Механизм образования связи
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
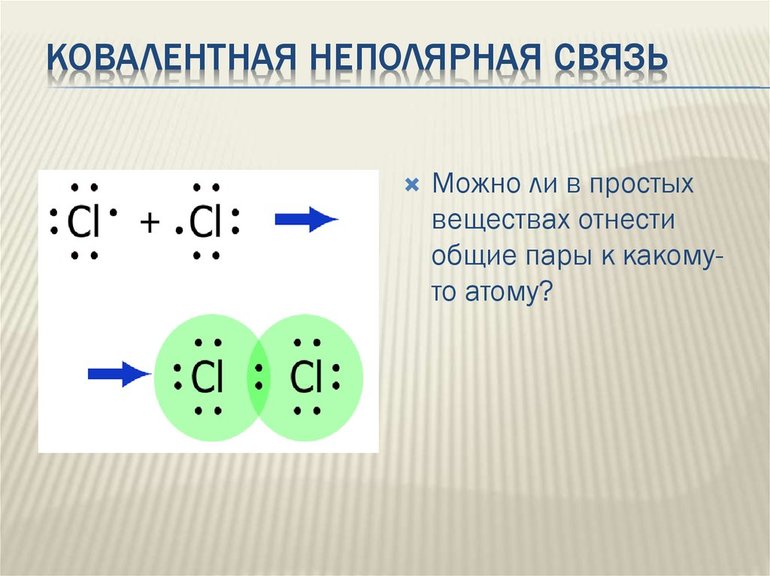
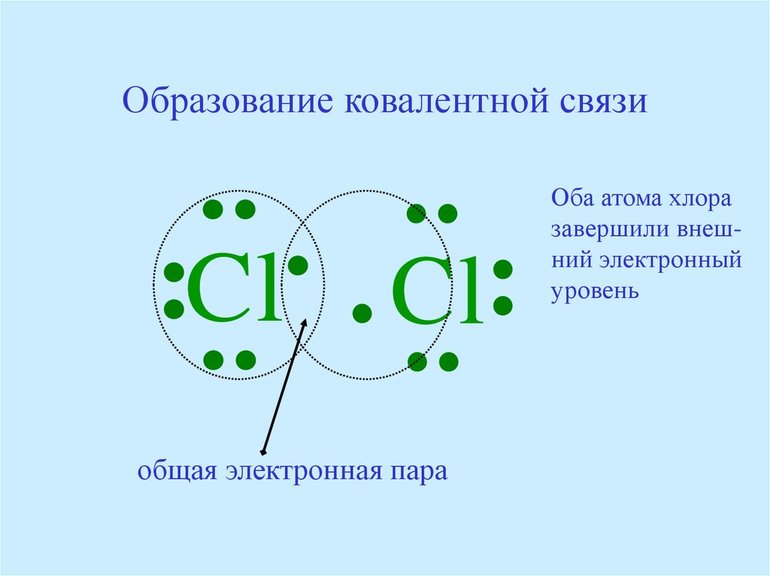
Рассмотрим механизм образования молекулы хлора: Cl2 – кнс.
Электронная схема образования молекулы Cl2:

Структурная формула молекулы Cl2:
Cl – Cl , σ (p – p) – одинарная связь
Рассмотрим механизм образования молекулы кислорода: О2 – кнс.
Электронная схема образования молекулы О2:

Структурная формула молекулы О2:
В молекуле кратная, двойная связь:
III. Ковалентная полярная химическая связь
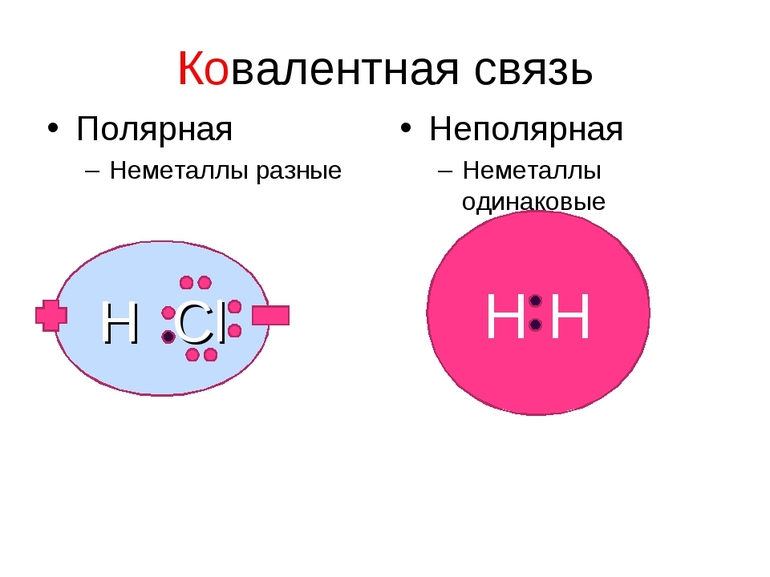
Ковалентная полярная связь (КПС) – образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (например, HCl, H2O).
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Электроотрицательность (ЭО) – это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастания ЭО).
Механизм образования связи
Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода: НCl – кпс.
Электронная схема образования молекулы НCl:

Структурная формула молекулы НCl:
– одинарная связь σ, смещение электронной плотности в сторону более электроотрицательного атома хлора (→)

Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов (NO3 – , CH3COO – ). Особенно много ковалентных полярных соединений среди органических веществ.
IV. Закрепление
Задание№1. Выпишите отдельно формулы веществ с ковалентной полярной и неполярной связями:H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Задание №2. Напишите механизм образования молекул с ковалентным типом связи, определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный): H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2
Ковалентная полярная и неполярная связь – определение, характеристика и примеры
Химические простые частицы имеют определённое направление и могут связываться друг с другом при помощи образования особых взаимодействий. Есть ковалентная полярная и неполярная связь веществ. Любая из частиц имеет своеобразный путь своего формирования и обстоятельства появления. Их взаимодействие в одно и то же время возникает из пары электронов, являющихся принадлежностью к обоим атомам. Ковалентные связи могут появиться в случае объединения орбиталей.
- Концепции и немного истории
- Типы ковалентной связи
- Полюсное взаимодействие
- Неполярная структура
- Квалифицирование ковалентности
Концепции и немного истории
Валентность показывает на присутствие конкретной силы. Появление подобной связи случается через обобщение атомных электронов, у которых нет «пары». Ковалентная связь случается между атомами неметаллов и может быть замечена как в молекулах, так и в кристаллах.
В первый раз ковалентность была открыта в 1916 г. химиком из Америки Дж. Льюисом, и прошло некоторое время, пока сформировалась гипотеза, а потом её смогли обобществить, и она была доказана опытным путём. Химики узнали, что это за прецедент, при котором выявили: электроотрицательность неметаллов довольно велика, и при содействии 2-х физических атомов притягивание электронов может быть сложной задачей и даже неосуществимой, поскольку они в 2-х атомах соединяются, и между ними случается ковалентность атомов.
Типы ковалентной связи

Характеристика ковалентности — это действие, которое случается в веществах с неметаллическими качествами. Выявляется она при совместном участии атомных электронов в различных элементах. Схема образования ковалентной полярной связи — взаимодействующие атомы имеют различный способ электроотрицательности, а открытые электроны не принадлежат тождественно 2 атомам.
Большую часть времени электроны приближаются к первому атому, чем ко второму. Случаем ковалентности полярной могут быть взаимодействия, которые выявляются в молекуле хлористого водорода, где раскрытые электроны в ответе за ковалентность и ближе к атому хлора, чем водород. И дело в том, что электроотрицательный показатель у первого вещества выше, чем у второго. Хорошим примером ковалентной полярной связи будет вода.
Эти одинарные химические взаимодействия происходят из-за появления накопительных молекулярных частей электронов, которые являются общими для двух взаимодействующих частей. Появление электронных пар связано с перекрытием орбиталей. Такие типы взаимодействий в химии происходят между частями обоих элементов.
Вещества со строением такой структуры:
- газы;
- вода;
- алкоголь;
- углеводы;
- белковая пища;
- кислотная органика.
Ковалентность появляется методом открытия пар электронов в несложных субстанциях или же сложных соединениях.
Чтобы квалифицировать природу кристаллической химической связи, надо взглянуть на атомную составляющую частиц, находящихся в формуле. Взаимодействия описанного типа образуются лишь только между веществами, в которых доминируют неметаллические качества. В случае если слияние имеет атомы похожих или же различных неметаллов, то взаимодействия между ними считаются ковалентными.
Полюсное взаимодействие
Когда в соединении совместно есть металл и неметалл, выявляется, что элементы образуют ионное соединение. Ковалентная полярность связывает решётку атомов всевозможных неметаллов друг с другом.
Это бывают атомы:
- хлора и водорода;
- фосфора и кислорода;
- аммиака.
Есть другое определение таких веществ. Это говорит о том, что кратная цепь возникает между неметаллами с разными показателями электроотрицательного появления. В 2-х случаях возможно выделить многообразие атомов, где была замечена эта связь.
Выставленные соединения в нормальных критериях наличествуют в водянистом или же газообразном агрегатном состоянии. Формулы Дж. Льюиса могут помочь понять устройство и насыщаемость связывания атомных ядер.
Действие получения ковалентности для атомов с разными значениями электроотрицательности объединяется к образованию совместной плотности электрического состояния. Как правило, он сдвинут к составляющей, что содержит самую возвышенную степень электроотрицательности. По причине возникающего смещения всей пары в направленности вещества с большим числом электроотрицательности в нём отчасти появляется негативный заряд. Вследствие этого, появляется слияние с 2-мя по-разному заряженными полюсами. Нередко при формировании полярных отношений применяется акцепторный или же донорно-акцепторный механизм.
Путь образования ковалентных связей:
- Акцепторный (обмена). Любой атом выделяет 1 неспаренный электрон.
- Донорно-акцепторный ковалентный тип. Один атом (донор) гарантирует электрическую пару, а акцептор орбиталь для неё.
Устройство образования ковалентных связей описывается как конфигурация взаимодействия, свойственная не для всех полярных соединений. Примерами считаются вещества органического и неорганического происхождения.
Неполярная структура
Неполярная ковалентность связывает составляющие с неметаллическими качествами, что точно так же равно электроотрицательному значению. Другими словами, элементы с неполярностью предполагают собой соединения, состоящие из различных чисел похожих неметаллов. Формула вещества с ковалентной неполярной связью: N2.
Примером ковалентной неполярной связи считаются вещества простой структуры: О2, N2, Cl2. Составление этого типа взаимодействия и других неметаллических частей включает экстремальные электроны. Валентность относится к количеству электронов, важных для окончания обычной наружной оболочки. Атом имеет возможность предоставить или же получить негативно заряженные частички.
Эта работа относится к уровню двухэлектронных или же двухцентровых цепей. В этом случае пара электронов занимает общую долю между 2-мя орбиталями. В структурных формулах пара электронов записывается в виде части по горизонтали. Каждая связь демонстрирует количество общих пар электронов в молекуле. Потребуется затратить наибольшее число энергии для разрушения с помощью этой связи, вследствие чего эти вещества станут одними из самых мощных по шкале крепости.
По донорно-акцепторному механизму неполярные части буквально не связаны. Ковалентная неполярная связь представляет собой структуру, образующуюся совместными электронными парами. Эти пары в равной степени принадлежат 2 атомам.
Однообразие ковалентных неполярных и полярных связей заключается в возникновении абсолютной электрической плотности. Лишь только в ином случае приобретённые электрические совместные части в равной степени принадлежат 2 атомам, занимающим центральное состояние. В итоге выборочные положительные и отрицательные заряды не образуются, что значит полученные цепочки считаются неполярными.
Неполярность приводит к образованию совместной пары, в итоге конечная степень атома будет законченной. Качества этих веществ, имеющих определённые структуры, выделяются от тех, что с металлическими или же ионными взаимодействиями. В обменном процессе ковалентности между атомами любой из них представляет собой один неспаренный электрон, образующий электрическую ковалентность. В этом случае они могут иметь обратные заряды.
Случаем подобной ковалентной связи могут быть взаимодействия, которые видятся в молекуле водорода. Когда атомы вещества намереваются совместно действовать, их электрические части попадают друг в друга. В итоге плотность между ядрами возрастает, они сами притягиваются, а энергия системы миниатюризируется. Впрочем, в случае если ядра делаются очень близкими, они начинают отталкиваться, и, таким образом, между ними появляется подходящее расстояние.
Что касается донорно-акцепторного вида ковалентности, то это случается, когда 1 из частиц, донор, предположит собственную электрическую пару для связи, а 2-я, акцептор, считается свободной орбиталью.
Квалифицирование ковалентности
Смысл ковалентной неполярной связи такой — это взаимодействие, которое появляется между похожими атомами. В молекулах с неполярной ковалентностью совместные пары электронов находятся на равных расстояниях от атомных ядер. К примеру, в молекуле воздуха атомы имеют 8 электрических конфигураций, в то время как они имеют 4 совместные электрические пары. Препараты с неполярной ковалентностью, как правило, предполагают собой газы, воду или же сравнительно низколегированные твёрдые вещества.
Чтобы верно квалифицировать ковалентную полярную и неполярную связь, достаточно понять свойство и формулу молекул, в случае, если они состоят из атомов различных составляющих, взаимодействие будет полярным, а если из 1-го, то станет неполярным. Ещё надо знать, что неполярные связи в целом могут встречаться лишь только между неметаллами, и это связано с механизмом ковалентных взаимодействий.
Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая

Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
Энергия химической связи — количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
Валентный угол — угол между линиями, соединяющими химически связанные атомы.
Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная.
Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
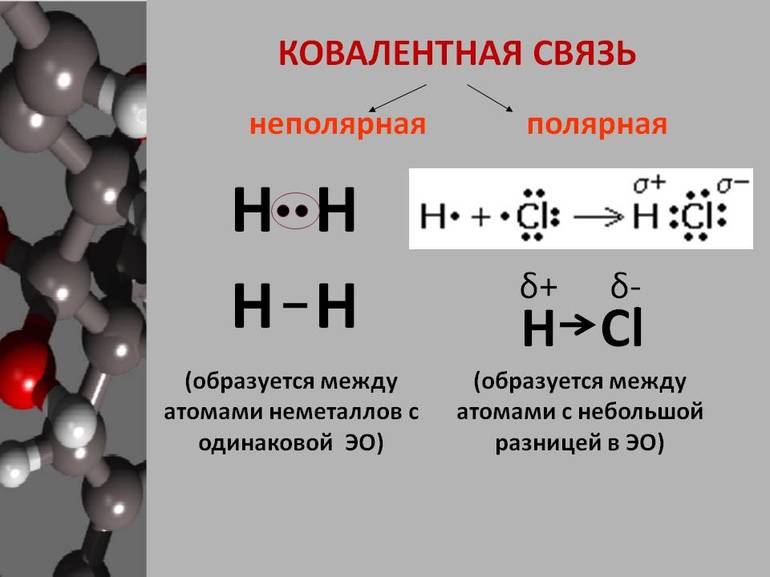
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов. Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O. Подробнее о шкале Полинга будет рассказано в следующем уроке.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Тренировочные задания
1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
3. Только ионной связью образовано каждое из веществ, формулы которых
4. Металлическая связь характерна для элементов списка
1) Ba, Rb, Se
2) Cr, Ba, Si
3) Na, P, Mg
4) Rb, Na, Cs
5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
6. Ионная связь образуется между элементами
1) хлором и бромом
2) бромом и серой
3) цезием и бромом
4) фосфором и кислородом
7. Ковалентная полярная связь образуется между элементами
1) кислородом и калием
2) серой и фтором
3) бромом и кальцием
4) рубидием и хлором
8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
1) от ионной связи к ковалентной полярной связи
2) от металлической к ковалентной неполярной
3) от ковалентной полярной связи до ионной связи
4) от ковалентной полярной связи до металлической связи
10. Длина химической связи Э–Н увеличивается в ряду веществ
11. Длина химической связи Э–Н уменьшается в ряду веществ
12. Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
13. Число электронов, которые участвуют в образовании химических связей в молекуле P2O5, —
14. В хлориде фосфора (V) химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
15. Наиболее полярная химическая связь в молекуле
1) фтороводорода
2) хлороводорода
3) воды
4) сероводорода
16. Наименее полярная химическая связь в молекуле
1) хлороводорода
2) бромоводорода
3) воды
4) сероводорода
17. За счёт общей электронной пары образована связь в веществе
18. Ковалентная связь образуется между элементами, порядковые номера которых
1) 3 и 9
2) 11 и 35
3) 16 и 17
4) 20 и 9
19. Ионная связь образуется между элементами, порядковые номера которых
1) 13 и 9
2) 18 и 8
3) 6 и 8
4) 7 и 17
20. В перечне веществ, формулы которых соединения только с ионной связью, это
§ 4. Ковалентная связь
Основным типом химических связей в органических соединениях является ковалентная связь. Рассмотрим механизм её образования и основные характеристики.
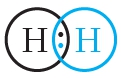
Простейший пример соединения с ковалентной связью — молекула водорода Н2. Атом водорода состоит из положительно заряженного ядра и одного неспаренного электрона, занимающего 1s-орбиталь. При сближении двух атомов водорода происходит перекрывание их электронных облаков:
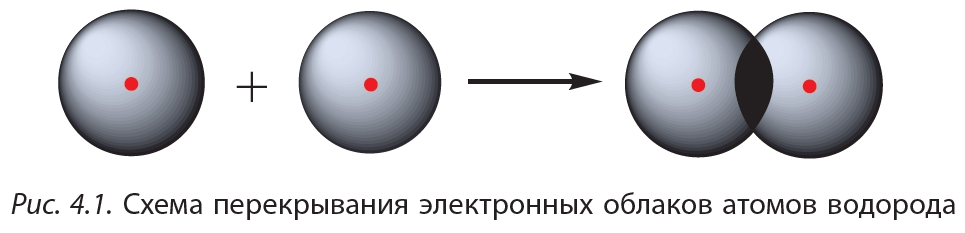

В результате в пространстве между ядрами происходит увеличение электронной плотности, то есть в этой области концентрируется отрицательный заряд. Этот отрицательный заряд притягивает положительно заряженные ядра, и между атомами формируется химическая связь. Образуется молекула водорода , или Н2. Такая связь называется ковалентной. Чем больше перекрываются электронные облака атомов, тем прочнее будет ковалентная связь.
Схему образования ковалентной связи между атомами водорода можно представить следующим образом:
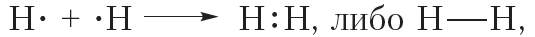
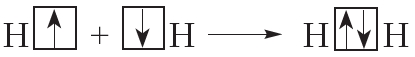
Из представленной схемы видно, что ковалентная связь осуществляется посредством общей электронной пары. В электронных формулах электронную пару обычно обозначают двумя точками, расположенными между атомами. Если вокруг таких атомов описать окружности, видно, что каждый атом водорода в молекуле имеет завершённую электронную оболочку, как у атома гелия:
В структурных формулах ковалентная связь обозначается чёрточкой:

Используя понятие общей электронной пары, можно дать краткое определение ковалентной связи.
| Ковалентная связь — химическая связь, образованная посредством общих электронных пар. |
В молекуле водорода общая электронная пара формируется за счёт неспаренных электронов двух атомов водорода. Следовательно, можно заключить, что число ковалентных связей, которое может образовать элемент, равно числу неспаренных электронов в его атоме.
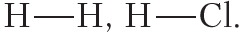
Например, в атоме водорода один неспаренный электрон, поэтому водород может образовать только одну ковалентную связь. Число ковалентных связей, которое образует данный атом в химическом соединении, называется его валентностью. Например, поскольку валентность водорода равна единице, то в структурных формулах от символа H следует рисовать одну чёрточку:
Рассмотрим основные характеристики ковалентной связи.
Кратность ковалентной связи
На внешнем слое атома фтора имеется один неспаренный электрон, поэтому валентность фтора в соединениях равна единице.
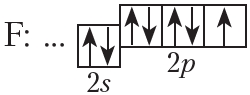
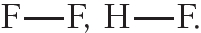
От символа F в структурных формулах следует рисовать одну чёрточку:
На рисунке 4.2. показана схема образования ковалентной связи в молекуле фтора:
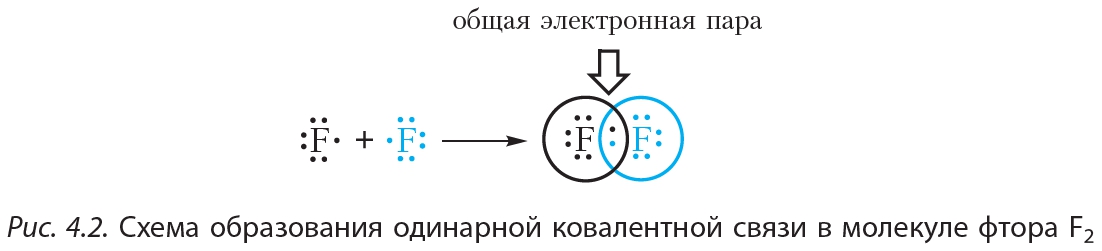
В молекуле фтора атомы связывает одна общая электронная пара. Такая связь называется одинарной.
На внешнем слое атома кислорода имеется два неспаренных электрона, поэтому валентность кислорода в соединениях равна двум.
От символа O в структурных формулах следует рисовать две чёрточки:
На рисунке 4.3 показана схема образования ковалентной связи в молекуле кислорода:
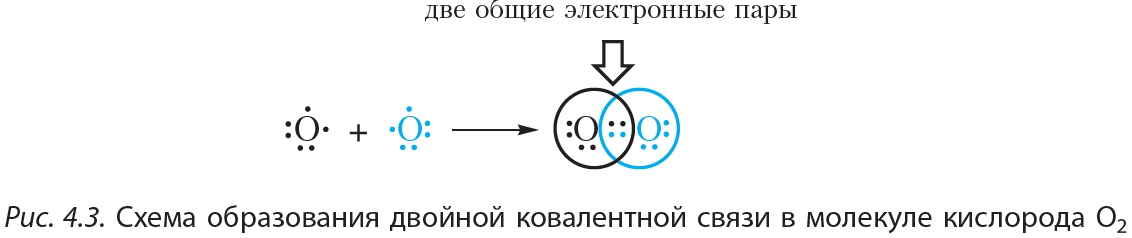
В молекуле кислорода атомы связывают две электронные пары. Такая связь называется двойной. Двойная связь прочнее одинарной.
На внешнем слое атома азота имеется три неспаренных электрона, поэтому валентность азота в соединениях равна трём.
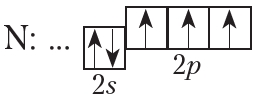
От символа N в структурных формулах следует рисовать три чёрточки:
На рисунке 4.4. показана схема образования ковалентной связи в молекуле азота:
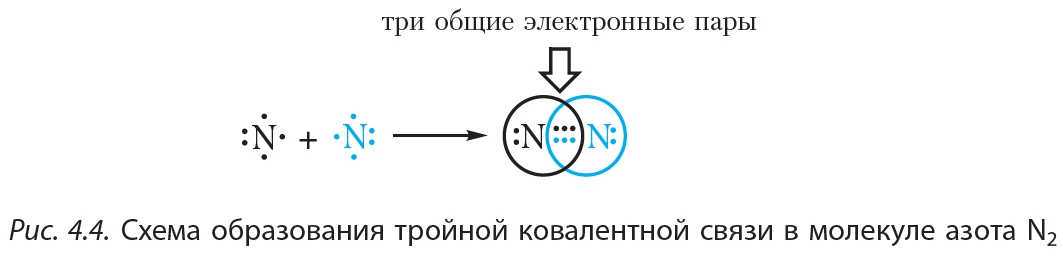
В молекуле азота атомы связывают три электронные пары. Такая связь называется тройной. Тройная связь прочнее одинарной и двойной.
Двойные и тройные связи имеют общее название кратные.
В основном состоянии на внешнем слое атома углерода имеется два неспаренных электрона. Однако, атом углерода легко переходит в возбуждённое состояние, в котором имеется четыре неспаренных электрона:
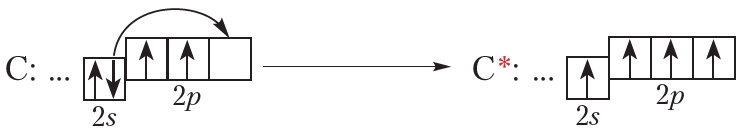
В связи с этим валентность углерода может быть равна четырём. В большинстве соединений углерод четырёхвалентен. Поэтому в структурных формулах от символа C следует рисовать четыре чёрточки:
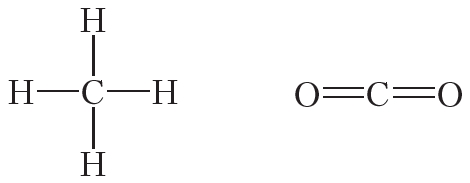
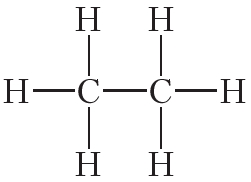
Атомы углерода могут связываться между собой как одинарными, так и кратными связями. Например, в молекуле этана, имеющего состав С2Н6, атомы углерода образуют только одинарные связи:
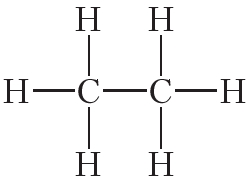
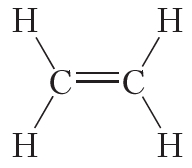
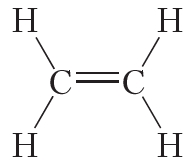
Двойной ковалентной связью атомы углерода соединены между собой в молекуле этилена (С2Н4):
Тройная связь между атомами углерода имеется в молекуле ацетилена (С2Н2):
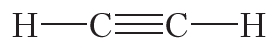
Энергия и длина ковалентной связи
Важнейшими характеристиками ковалентной связи являются её энергия и длина.
Энергия, которую необходимо затратить для разрыва химической связи, называется энергией связи. Энергия связи измеряется в кДж/моль. Чем прочнее связь, тем больше энергии необходимо затратить на её разрыв, следовательно, тем больше энергия связи.
Энергия кратных связей больше, чем одинарных (табл. 4.1). Это вполне понятно, так как для разрушения двух или трёх связей требуется затратить больше энергии, чем для разрыва одной связи.
Атомы, соединённые химической связью, находятся на определённом расстоянии друг от друга. Расстояние между ядрами атомов, образующих связь, называется длиной связи.
Из данных таблицы 1.4 видно, что в ряду этан — этилен — ацетилен с ростом кратности длина связи углерод-углерод уменьшается. То есть при образовании кратных связей атомы сильнее притягиваются друг к другу.
Таблица 4.1. Энергия и длина связи углерод-углерод в некоторых молекулах
Энергия связи углерод-углерод, кДж/моль
Длина связи углерод-углерод, нм
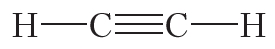
Полярность ковалентной связи
В молекуле водорода H2 ковалентная связь образуется между атомами одного элемента, поэтому общая электронная пара располагается симметрично (посередине) между ядрами атомов. Такая связь называется ковалентной неполярной.
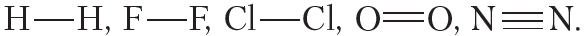
Пример 1. Ковалентной неполярной связью соединяются между собой атомы неметаллов в простых веществах
Кроме того, ковалентная неполярная связь образуется между атомами углерода в этане , этилене и ацетилене .
При образовании ковалентной связи между атомами разных химических элементов общая электронная пара смещается к более электроотрицательному атому. Такая связь называется ковалентной полярной.
Напомним, что электроотрицательность — это способность атома в химическом соединении притягивать к себе электроны других атомов. Самый электроотрицательный элемент — фтор (ЭО — 4,1).

Пример 2. Ковалентная полярная связь в молекуле фтороводорода HF. Молекула образована атомами водорода и фтора. Электроотрицательность фтора выше, чем водорода, поэтому общая электронная пара будет смещена к более электроотрицательному атому фтора (рис. 4.5).
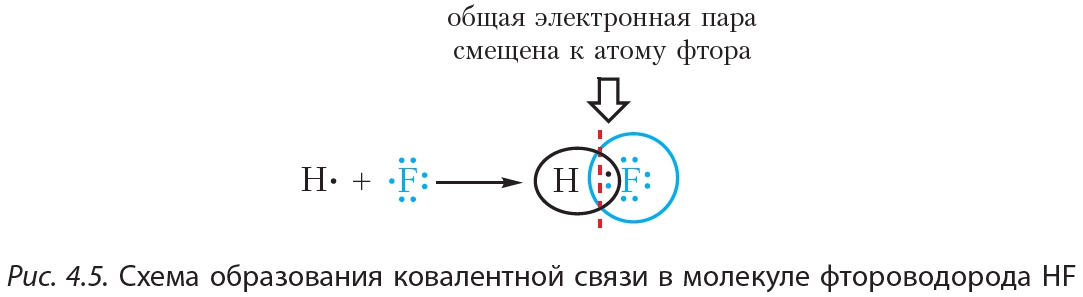
В результате на атоме фтора возникает частичный отрицательный заряд, на атоме водорода — частичный положительный. Частичные, а не полные заряды возникают вследствие того, что общая электронная пара смещается к атому фтора, но полного перехода электрона от одного атома к другому не происходит. Частичный заряд обозначается греческой буквой δ (дельта):
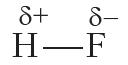
Связь между атомами водорода и фтора является ковалентной полярной.
Ковалентная полярная связь возникает между атомами неметаллов с различной электроотрицательностью, например в молекулах хлороводорода, воды, аммиака:
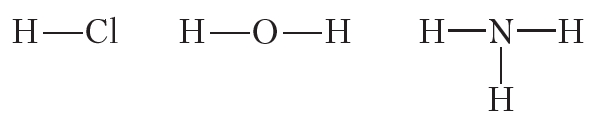
Чем сильнее различаются между собой электроотрицательности атомов, образующих ковалентную связь, тем больше будут частичные заряды на атомах и тем более полярной будет связь.
Пример 3. Ковалентные полярные связи в молекулах фтороводорода HF и хлороводорода HCl.
Таблица 4.2. Электроотрицательности и частичные заряды на атомах в молекулах HF и HCl
Частичные заряды на атомах
Из таблицы 4.2 видно, что частичные заряды на атомах в молекуле HF значительно больше, чем в молекуле HCl. Следовательно, связь в молекуле HF более полярна, чем в HCl.
Ковалентная связь осуществляется посредством общих электронных пар. В электронных формулах общую электронную пару обозначают двумя точками, расположенными между атомами. В структурных формулах ковалентную связь обозначают чёрточкой.
Ковалентная связь образуется между атомами неметаллов. Между атомами одного и того же неметалла возникает ковалентная неполярная связь. Между атомами разных неметаллов — ковалентная полярная.
Ковалентная связь бывает одинарной, двойной и тройной. Двойная и тройная связи называются кратными.
Чем прочнее связь, тем больше энергия связи. Энергия кратных связей выше энергии одинарных связей. Кратные связи короче одинарных связей.
Вопросы и задания
1. При помощи электронных формул изобразите образование ковалентных связей в молекулах HCl, H2O, NH3, CH4. Укажите валентности элементов в этих веществах.
2. Учитывая, что валентность водорода и хлора равна единице, углерода — четырём, а кислорода — двум, напишите структурные формулы молекул: CCl4, CO2, CH3Cl, C2H6, C2H4, C2H2, C2H5Cl.
3. В какой молекуле, H2O или NH3, ковалентные связи более полярные? Составьте структурные формулы этих молекул и укажите знаки частичных зарядов на атомах.
4. Напишите структурную формулу пероксида водорода H2O2. Укажите полярные и неполярные связи.
5. В какой молекуле, O2 или H2O2, энергия связи кислород-кислород больше?
6. При сильном нагревании может происходить разрыв связей в молекулах. При этом молекулы распадаются на атомы. Какое вещество, Cl2 или N2, будет более устойчиво к нагреванию (термически устойчиво)?
Ковалентная химическая связь: полярная, неполярная, схемы образования и примеры молекул
Ключевые слова конспекта: Ковалентная неполярная и полярная связь. Электроотрицательность. Кратность ковалентной связи. Обменный и донорно–акцепторный механизмы образования ковалентных связей. Полярность связи. Полярность молекулы. Молекулярные и атомные кристаллические решётки.
Все органические соединения (их более 100 миллионов!) построены за счёт ковалентной химической связи. Однако и неорганических соединений с ионной связью меньше, чем с ковалентной.
Теорию ковалентной связи в 1916 г. предложил американский химик Гилберт Льюис. Он объяснил, как возникает химическая связь в двухатомных молекулах водорода Н2, азота N2, кислорода O2, галогенов (F2, Сl2, Вг2, I2).
Вспомним механизм образования некоторых двухатомных молекул на примере водорода и хлора.

Атом водорода на единственной s-орбитали содержит один электрон. Два атома объединяют непарные электроны в общую пару. Следовательно, у атомов водорода в распоряжении уже два электрона, т. е. их электронная оболочка завершена до устойчивой двухэлектронной оболочки благородного газа гелия.
В структурных формулах общая электронная пара обозначается чёрточкой.
| Ковалентной , или атомной химической связью , называется связь между атомами за счёт образования общих электронных пар. |
Условно этот процесс можно представить следующим образом. При сближении двух атомов водорода происходит перекрывание их сферических s-орбиталей до тех пор, пока сила отталкивания ядер не будет равна силе притяжения между ядром одного атома и электроном другого. Место взаимопроникновения орбиталей называется электронной плотностью. Это область пространства, где сосредоточен повышенный отрицательный заряд.

Атомы хлора в основном состоянии содержат неспаренный электрон не на s-, а на р-орбитали. В молекуле хлора Сl2 образование химической связи, т. е. общей электронной пары, происходит за счёт перекрывания р-орбиталей.
Атомы в молекулах водорода и хлора образовали одну общую электронную пару. Такая ковалентная связь называется простой или одинарной.

Иначе образуется химическая связь между двумя атомами азота, имеющими на внешнем энергетическом уровне по пять валентных электронов. До устойчивой восьмиэлектронной оболочки каждому атому не хватает трёх электронов, поэтому атомам придётся предоставить в общую копилку по три электрона и образовать три электронные пары:
Посчитайте: в молекуле азота каждый атом распоряжается восьмью электронами. Два атома азота в молекуле N2 связаны уже не одинарной, а тройной связью. Очевидно, что такая связь гораздо прочнее. Это и объясняет очень низкую реакционную способность азота.
Следовательно, по числу общих электронных пар, связывающих атомы в молекулы, т. е. по кратности, различают одинарную, двойную и тройную связи.
В рассмотренных примерах ковалентные связи образовывались между одинаковыми атомами, т. е. атомами одного элемента. Понятно, что эти два атома равноправны по отношению к общим электронным парам, которые симметрично располагаются между ядрами двух атомов. Такая химическая связь называется ковалентной неполярной.
| Ковалентная связь между атомами одного элемента называется ковалентной неполярной связью . |
Ковалентная связь может образоваться между двумя атомами, которые в соответствии с положением в периодической системе обладают различными неметаллическими свойствами. Усиление неметаллических свойств проявляется в стремлении атома оттянуть общую электронную пару к себе.
| Способность атомов химических элементов оттягивать к себе общие электронные пары ковалентной связи называется электроотрицательностью . |

Самым электроотрицательным элементом является фтор, за ним неметаллы располагаются следующим образом:

Между атомами разных химических элементов–неметаллов наблюдается аналогичный механизм возникновения ковалентной связи, например:

Однако в этом случае общие электронные пары смещаются в сторону более электроотрицательного элемента. В результате в молекуле НСl и СН4 на атомах хлора и углерода образуются избыточные отрицательные заряды, которые обозначаются δ – (греческая буква «дельта»), а атомы водорода с дефицитом электронной плотности несут частичные положительные заряды δ + :
| Ковалентная связь между двумя атомами с различной электроотрицательностью называется ковалентной полярной связью . |
Понятно, что между атомами с одинаковой электроотрицательностыо (атомами одного химического элемента-неметалла) образуется ковалентная неполярная связь.
В результате полярности связи Н—Сl молекула хлороводорода представляет собой частицу с двумя противоположно заряженными полюсами — диполь.
Несмотря на то, что в молекуле метана каждая из связей С—Н полярна, она не является диполем. Причина в том, что молекула метана имеет форму правильного тетраэдра, а потому полярность всех связей взаимно компенсируется.
Следовательно, полярность молекулы определяется двумя факторами: полярностью связей в молекуле и её геометрией.

Например, молекулы воды — диполи, имеющие угловую форму:

Наоборот, линейные молекулы СО2 (углекислого газа) неполярны: , хотя двойные связи С=O сильно поляризованы.
В рассмотренных примерах при образовании полярных и неполярных молекул был реализован обменный механизм возникновения ковалентной связи: каждый из участвующих атомов предоставлял другому на паритетных началах свои непарные электроны, образуя таким образом общие (поделённые) электронные пары. Однако имеется ещё один механизм образования ковалентной связи — донорно-акцепторный.
Рассмотрим его на примере строения катиона аммония NH4 + .

В молекуле аммиака NH3 по обменному механизму образуется три ковалентные полярные связи N—Н. В результате атом азота получает завершённый внешний слой из восьми электронов, в котором имеется собственная пара электронов, называемая неподелённой. К ней может присоединиться атом водорода, потерявший свой единственный электрон — катион водорода Н + . Образуется четвёртая связь N—Н, при этом атом азота, предоставивший для её образования свою пару электронов, называется донором, а катион водорода со свободной орбиталью — акцептором. Получившаяся при этом частица несёт положительный заряд и называется катионом аммония:
В результате образования ковалентных связей возникают молекулы. Такая связь преобладает в химических соединениях и значит все они имеют молекулярное строение. Это почти 100 млн органических соединений, большинство веществ, которые при обычных условиях представляют собой газы и жидкости, а также некоторые твёрдые вещества, например ромбическая сера, белый фосфор.
Ковалентная связь определяет два типа решёток: молекулярные и атомные.
В узлах кристаллической решётки вещества молекулярного строения находятся молекулы этого вещества, поэтому кристаллическая решётка такого типа называется молекулярной.
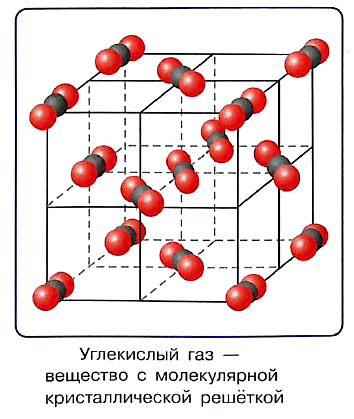
Молекулярную кристаллическую решётку имеют вода, большинство органических веществ, кристаллический йод, сера, почти все переведённые в твёрдое состояние жидкие и газообразные вещества, например «сухой лёд» — твёрдый углекислый газ.
Атомы в молекулах таких веществ связаны достаточно прочными ковалентными связями, а вот между молекулами связи значительно более слабые (вандерваальсовы силы). Разрушить молекулярную кристаллическую решётку нетрудно, поэтому соединения такого строения обычно легкоплавкие, летучие, часто обладают запахом.
Ковалентные связи могут приводить к образованию веществ не только молекулярного, но и атомного строения, т. е. с атомными кристаллическими решётками. В узлах таких кристаллических решёток располагаются отдельные атомы, связанные между собой очень прочными ковалентными связями. Атомная кристаллическая решётка характерна для некоторых простых веществ, например, модификаций бора, кремния, углерода. Если каждый углеродный атом в решётке находится в центре тетраэдра и окружён четырьмя другими атомами углерода, с которыми связан ковалентными неполярными связями, образуется кристаллическая решётка алмаза.

Высокой твёрдости алмаза присвоен высший балл (10) по шкале Мооса.
Это свойство используется для изготовления абразивных (от фр. abrasif — шлифовальный) инструментов, которые предназначены для шлифования, полирования, бурения металлов, керамических материалов, горных пород и т. д. Отшлифованные алмазы — бриллианты — используются в ювелирном деле.
Однако атомы углерода в кристаллической решётке могут располагаться слоями, образуя правильные шестиугольники наподобие пчелиных сот. Между атомами углерода соседних слоёв расстояние больше, чем в слоях, поэтому и связи менее прочные. Такую решётку имеет графит.
Это приводит к тому, что графит, в отличие от алмаза, электропроводен и мягок, но обладает высокой тугоплавкостью. Его используют для изготовления электродов и замедлителей нейтронов в ядерных реакторах. При высоких температурах и давлении из графита получают технические алмазы. Способность оставлять след на бумаге — свойство, на котором основано применение карандашей.
Гораздо более характерны атомные кристаллические решётки для сложных веществ. К ним относятся минералы, основу которых составляют оксид алюминия (наждак, корунд, рубин, сапфир) и оксид кремния(IV) (кварц, кремнезём, горный хрусталь).

Конспект урока по химии «Ковалентная химическая связь». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Ковалентные неполярные и полярные связи

Алмаз и кремний имеют высокую твердость и не растворяются в воде, а кристаллы поваренной соли хоть и тверды, но отлично растворимы. Эти физические свойства обусловлены разным строением вещества и разными химическими связями между атомами. В этом материале, основанном на программе 9 класса, мы рассмотрим наиболее прочные химические связи в молекуле — ковалентные.
О чем эта статья:
Что такое ковалентная связь
На примере ковалентных связей удобно описывать механизм химической связи в целом. Впервые это сделал американский ученый Гилберт Льюис, анализируя взаимодействие между частицами в молекулах водорода, азота, кислорода и других простых неметаллов.
Как происходит такое взаимодействие? Атом водорода отличается очень простым строением — его электронное облако или орбиталь содержит лишь один свободный (валентный) электрон. При сближении двух атомов водорода их орбитали пересекаются и начинают частично перекрывать друг друга.
Свободные электроны на этих орбиталях объединяются в пару, которая принадлежит обоим участникам взаимодействия. Это и есть процесс образования ковалентной связи. По ее итогам каждый атом имеет уже два электрона и приобретает устойчивую внешнюю оболочку.
Ковалентная связь — это образование общей электронной пары у двух атомов вещества при сближении ядер этих атомов.
В зависимости от того, будет ли пара принадлежать обоим атомам в равной мере или сместится к одному из них, ковалентная связь бывает полярной или неполярной.
Ковалентная неполярная связь
Приведенный выше пример с атомами водорода иллюстрирует ковалентную неполярную связь. Образованная пара электронов находится на общей молекулярной орбитали и принадлежит обоим атомам. Это происходит потому, что в простых веществах взаимодействуют атомы с одинаковой электроотрицательностью (ЭО), т. е. они имеют равную способность притягивать электроны.
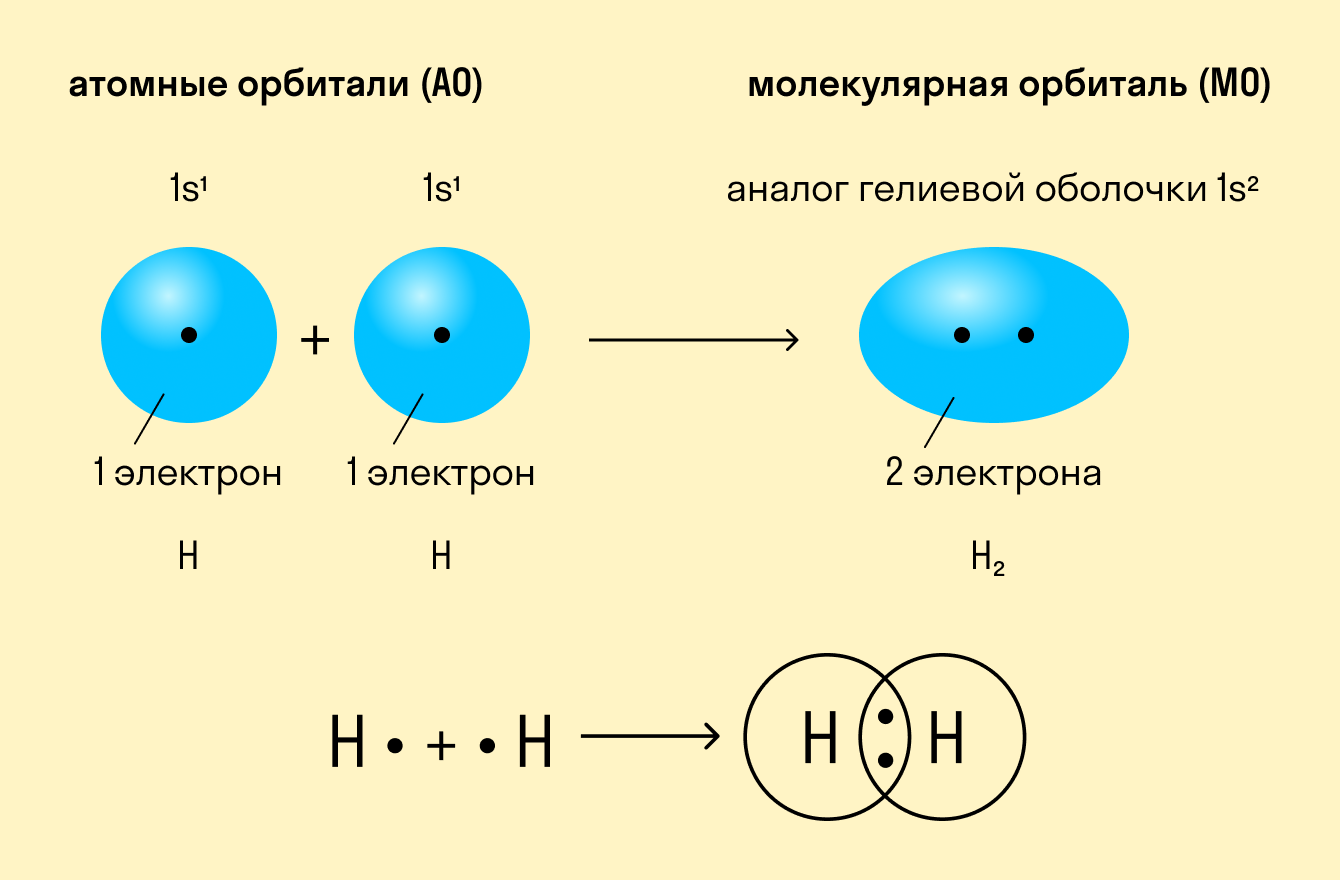
Ковалентная неполярная связь — это такое взаимодействие двух атомов, при котором их общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам. Другими словами, электронная плотность (область, в которой наиболее вероятно нахождение электронов) распределена равномерно.
Ковалентная неполярная связь образуется между атомами элементарных веществ с одинаковой ЭО.
Интересный пример ковалентной связи этого типа — молекула ромбической серы S8. У атома серы есть 2 свободных электрона, поэтому он может образовать 2 связи. Это простое вещество, а значит, все атомы будут притягивать электроны с одинаковой силой.
Формула данного вещества с ковалентной неполярной связью:

Ковалентная полярная связь
Мы рассмотрели, как проходит ковалентная химическая связь в молекулах, где все частицы одинаковы. Но если сблизить два атома с разной ЭО — например, водорода и хлора, получится другая картина. Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем водород, общая пара смещается в его сторону. Другими словами, у такой химической связи есть полярность.
Атом, принимающий электроны (в данном случае хлор), приобретает условно отрицательный заряд. Второй же атом, отдающий валентные электроны, заряжается положительно.
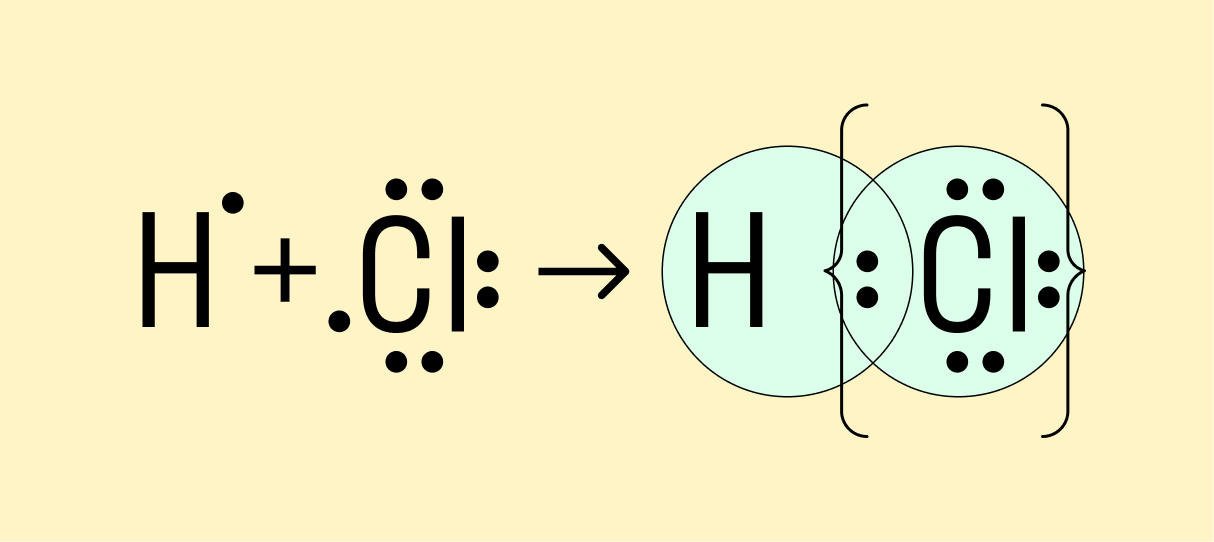
Ковалентная полярная связь — это электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому (более электроотрицательному). Электронная плотность распределена неравномерно.
Ковалентная полярная связь образуется между атомами неметаллов с разной ЭО в составе сложных веществ.
Проиллюстрируем все, о чем сказано в определении ковалентной полярной связи, на примерах.
В молекуле аммиака NH3 атом азота имеет 3 свободных электрона, т. е. может образовать 3 химические связи. Поскольку это сложное вещество, состоящее из атомов неметаллов, можно говорить о полярности. Атом азота имеет общие электронные пары с тремя атомами водорода. При этом азот обладает более высокой ЭО, чем водород, поэтому электронная плотность смещена в его сторону.
Формула данного вещества с ковалентной полярной связью:
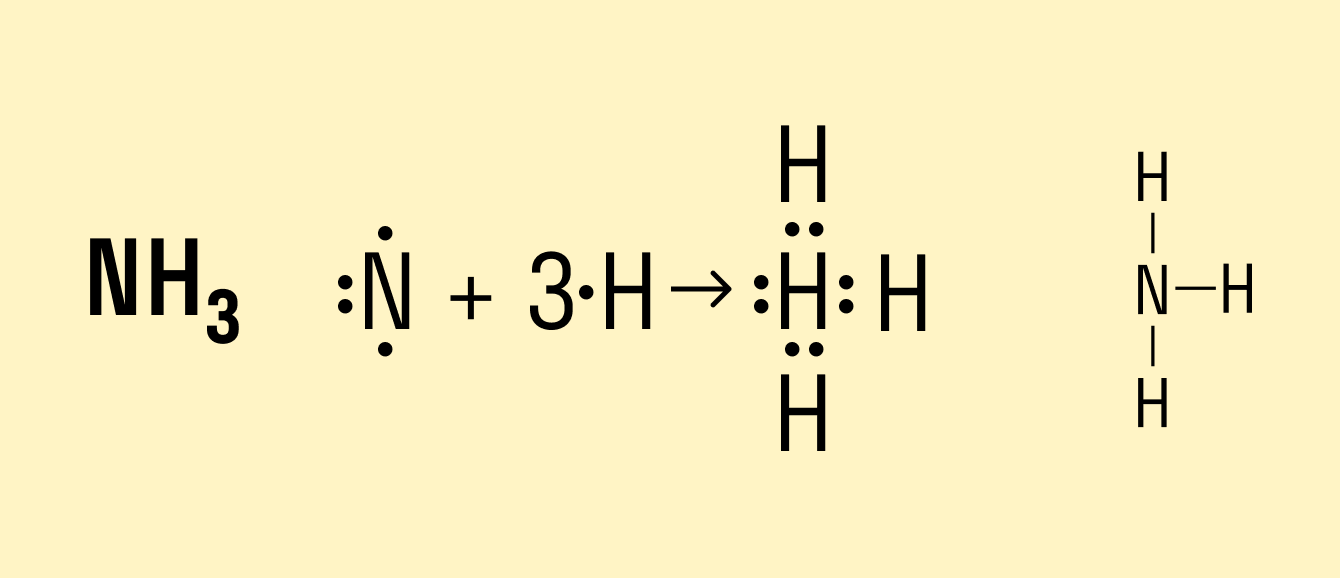
Механизмы образования ковалентной связи
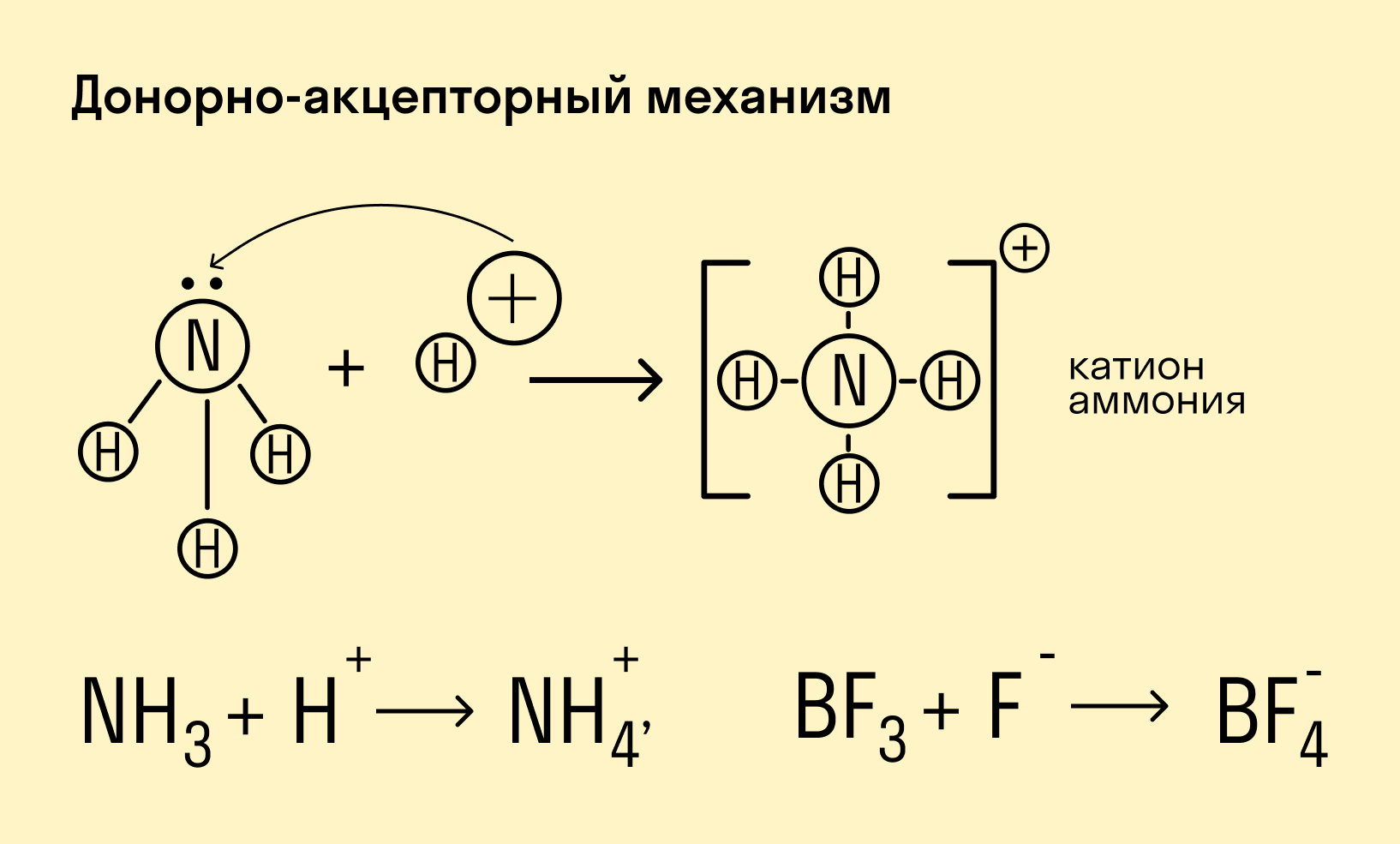
Не всегда взаимодействие атомов происходит так, как в молекуле водорода. Иногда один атом отдает оба электрона, а второй забирает их на свою свободную орбиталь. В зависимости от этого выделяют два механизма ковалентной связи:
Обменный механизм — объединение в пару свободных электронов от взаимодействующих атомов (по одному электрону от каждого).
Донорно-акцепторный механизм — процесс, при котором атом-донор отдает два электрона, а атом-акцептор предоставляет для них орбиталь.
Химическую связь, образованную по донорно-акцепторному принципу, можно рассмотреть на примере молекулы катиона аммония. В данном случае атом азота, который содержится в аммиаке NH3, имеет неподеленную пару электронов и является донором. Он передает эти электроны на орбиталь атома водорода — акцептора. В результате такой связи образуется молекула NH4 + в форме тетраэдра, где углы представлены четырьмя атомами водорода.
Вещества, в молекулах которых есть хотя бы одна ковалентная химическая связь, осуществляемая по донорно-акцепторному принципу:
NH4 + Cl, NH4 + Br;
Кратность ковалентной связи
Ковалентная связь может подразумевать образование как одной пары электронов, так и двух или даже трех. Исходя из того, сколько именно получилось пар, выделяют одинарные, двойные и тройные связи. В формулах они обозначаются соответствующим количество черточек.
Кратность ковалентной связи — это количество созданных общих электронных пар у двух атомов.
Например, в молекуле хлора Cl2 каждый атом содержит по одному валентному электрону на внешней p-орбитали. При сближении атомов происходит перекрывание орбиталей и свободные электроны соединяются в одну общую пару. Это одинарная ковалентная связь. В данном случае она будет неполярной, поскольку речь идет о простом веществе.
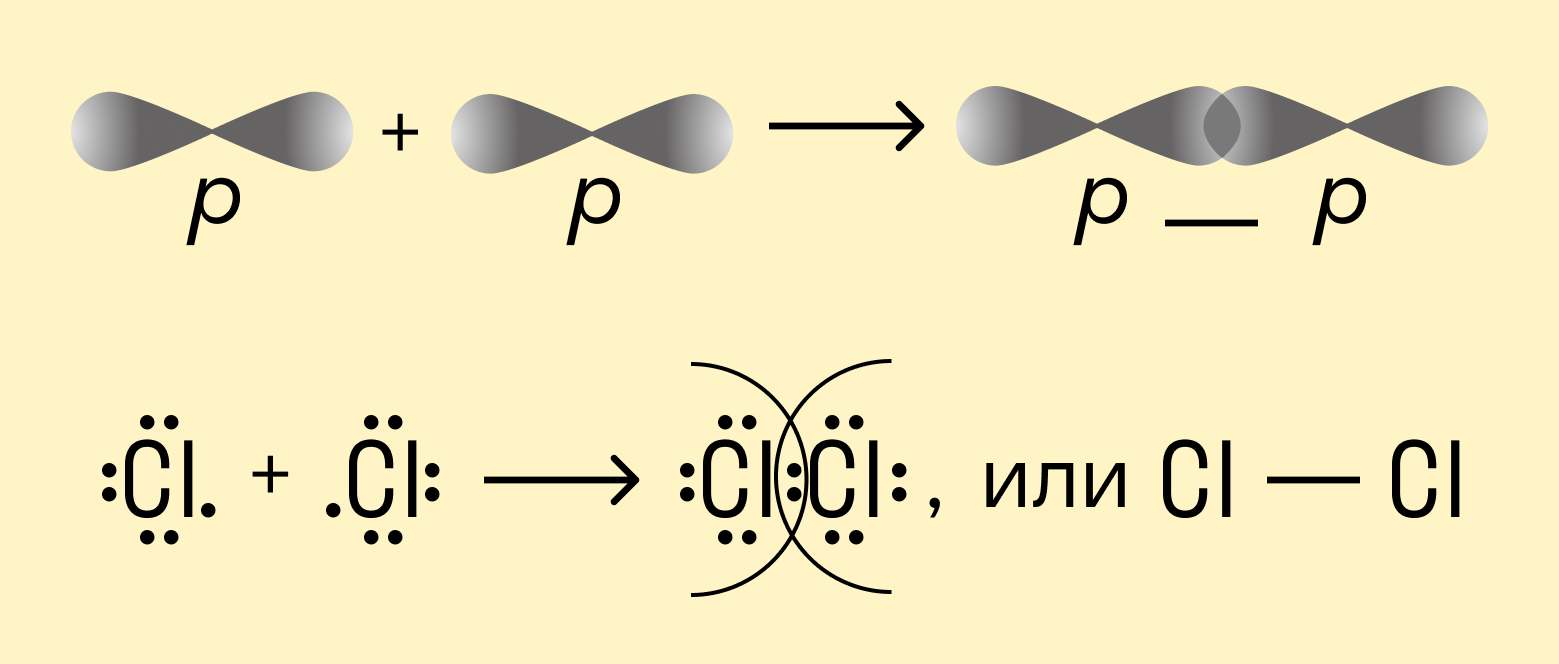
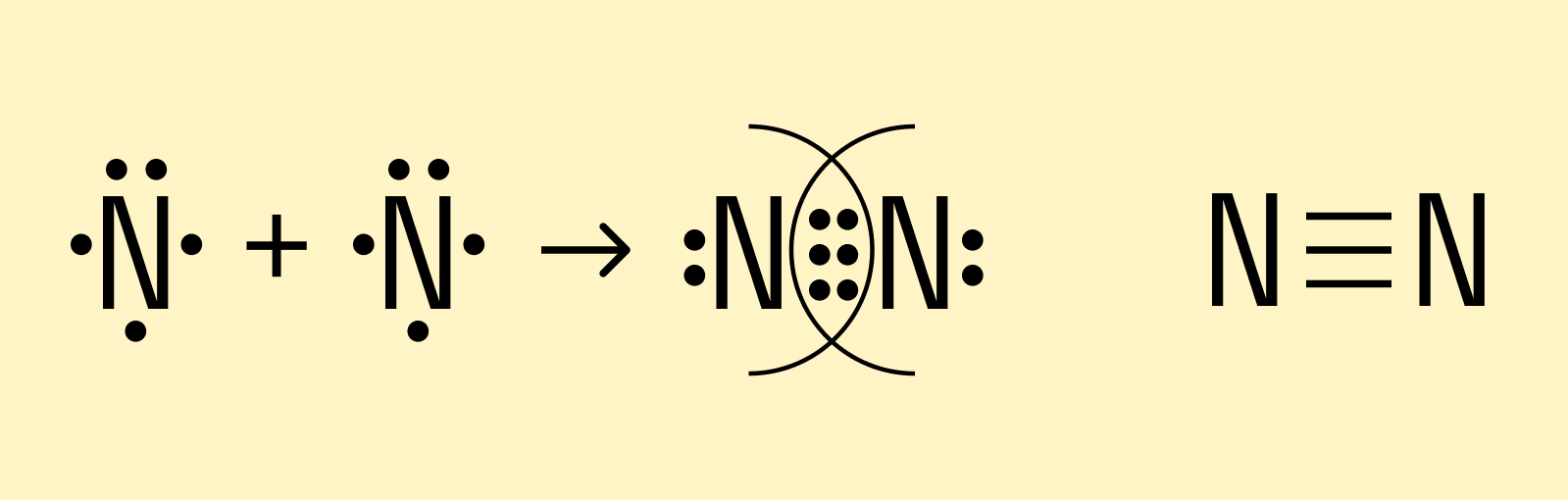
Посмотрим теперь, что происходит с атомами азота, у которых на внешней орбитали целых 5 валентных электронов. Как мы помним, все частицы стремятся приобрести устойчивую форму, которая предполагает двухэлектронную или восьмиэлектронную внешнюю оболочку. Таким образом, атомам азота нужно довести количество электронов на внешней орбитали до 8, для чего они отдают в общие пары по 3 электрона. В результате получаются 3 электронные пары, и такая химическая связь называется тройной.
Характеристики ковалентной связи
К ковалентным связям применимы те же общие закономерности, что и для других типов. Например, чем меньше длина ковалентной связи, тем она прочнее. Но есть и специфические свойства, которые появляются только при этом виде взаимодействия:
Насыщаемость ковалентной связи
Насыщаемость говорит об ограничениях по количеству взаимодействий, в которые может вступать один атом. Таких взаимодействий, т. е. химических связей, может быть ровно столько, сколько у атома неспаренных электронов. Как мы помним из примеров выше, у водорода один валентный электрон, поэтому он может образовать только одинарную ковалентную связь.
Количество свободных электронов может увеличиться, если атом перейдет в возбужденное состояние. В этом случае происходит распаривание электронов и перемещение их на свободные орбитали более высоких подуровней внешнего уровня. Эти распаренные электроны также способны вступать в химические связи.
Полярность ковалентной связи
Полярность связи — это смещение электронной плотности к одному из атомов. Чем больше выражено такое смещение, тем более полярной является связь. Напомним, что электронная плотность смещается всегда в сторону более электроотрицательного элемента. Следовательно, большая разница в ЭО между атомами обуславливает высокую полярность связи.
Атом, к которому смещается общая пара электронов, заряжается отрицательно. Данный заряд обозначают буквой δ – . Второй атом заряжается положительно, и этот заряд обозначают буквой δ + . Очень часто центры положительного и отрицательного зарядов разделяет некоторое расстояние. Молекулы с таким устройством называют диполями (поскольку они имеют два полюса)
Логично предположить, что ковалентная полярная химическая связь всегда ведет к образованию диполей. Но это не так. В одной молекуле часто присутствует несколько типов связи, и если один из них вызывает смещение электронной пары, то другой может это компенсировать. В таком случае получится неполярная молекула (например, CO2)
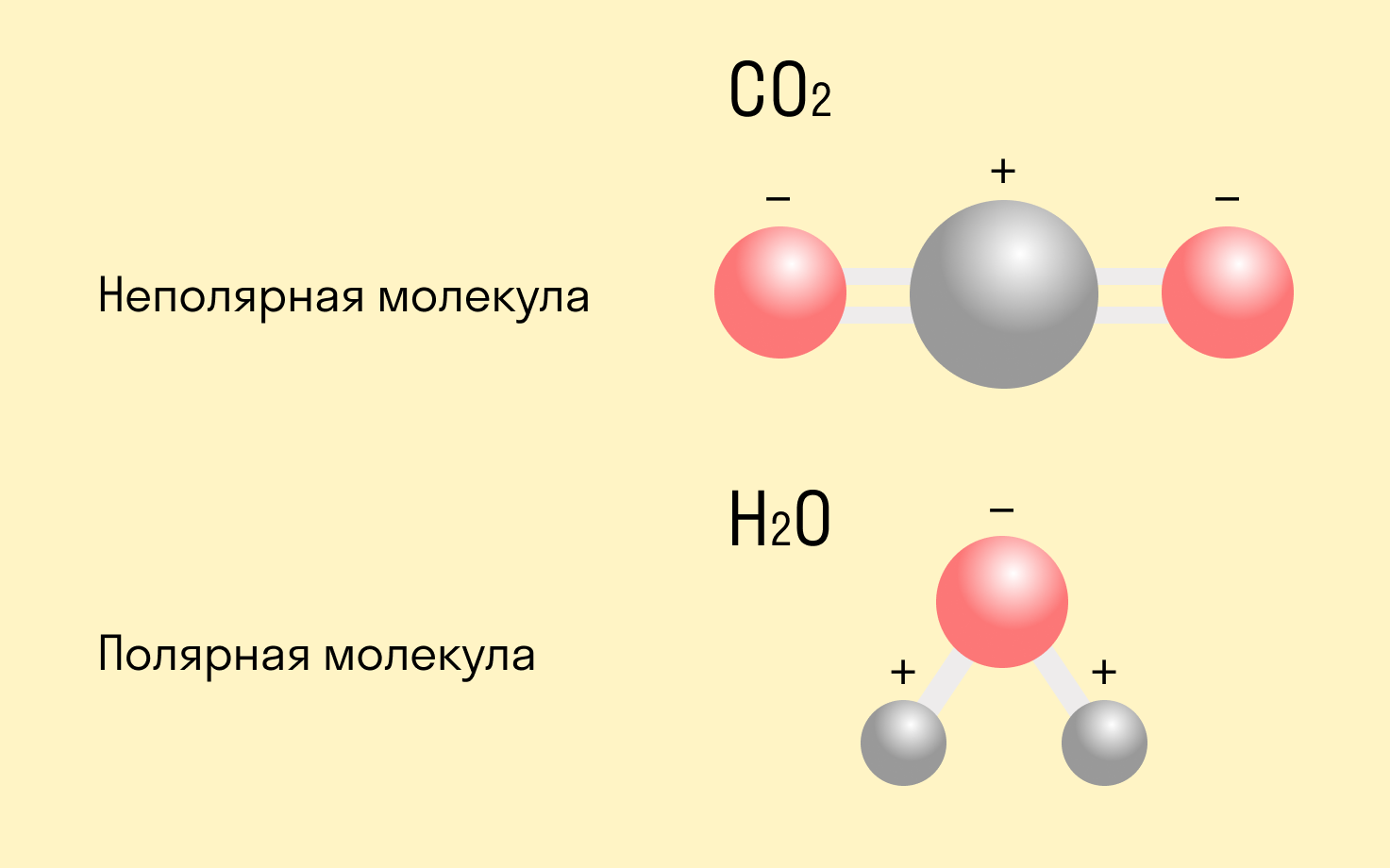
Смещение электронной плотности в сторону одного из атомов, связанных ковалентной полярной связью, в структурной формуле можно обозначить стрелкой или дугой. Стрелка используется, если перекрываемые орбитали атомов находятся на одной оси, а дуга — если они расположены под углом.
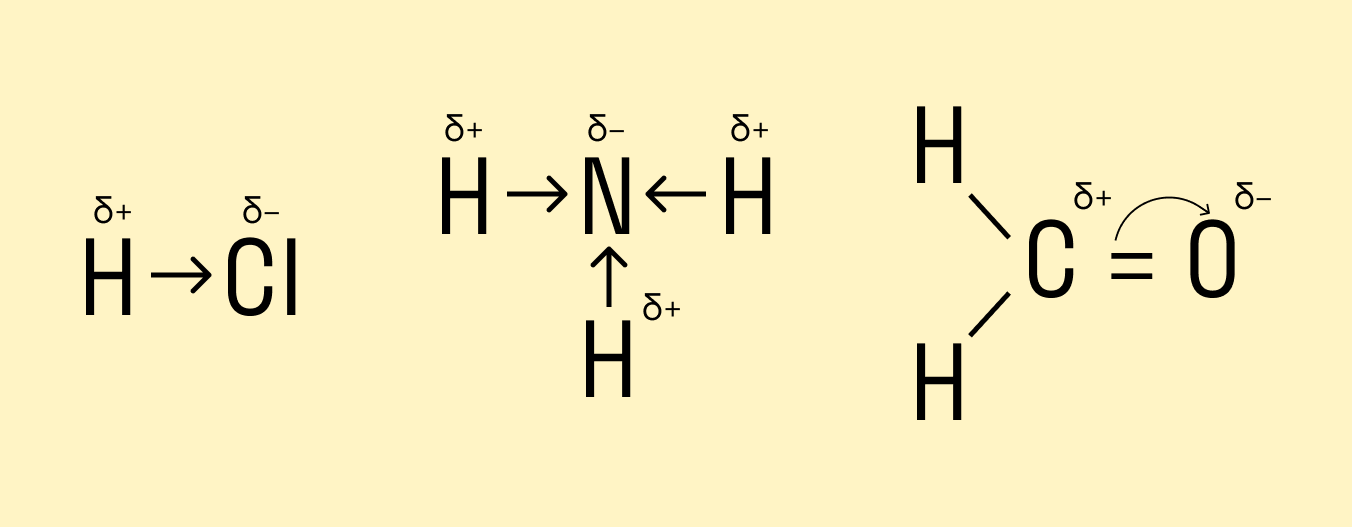
Направленность ковалентной связи
Ковалентная связь становится направленной, если в ней участвуют атомы, чьи орбитали (электронные облака) находятся под определенным углом друг к другу. Если провести воображаемые линии между связанными атомами, можно увидеть этот угол — он называется валентным. По значениям валентных углов легко определить строение молекулы вещества, ее геометрическую форму.
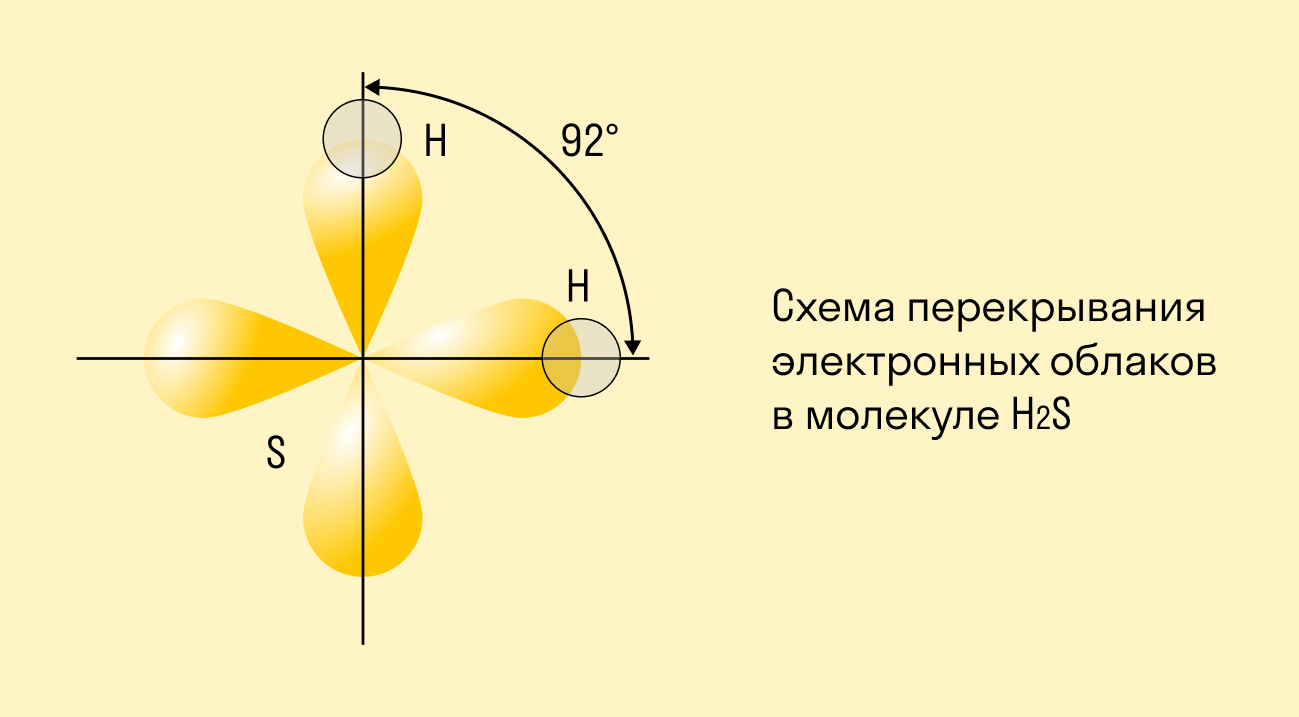
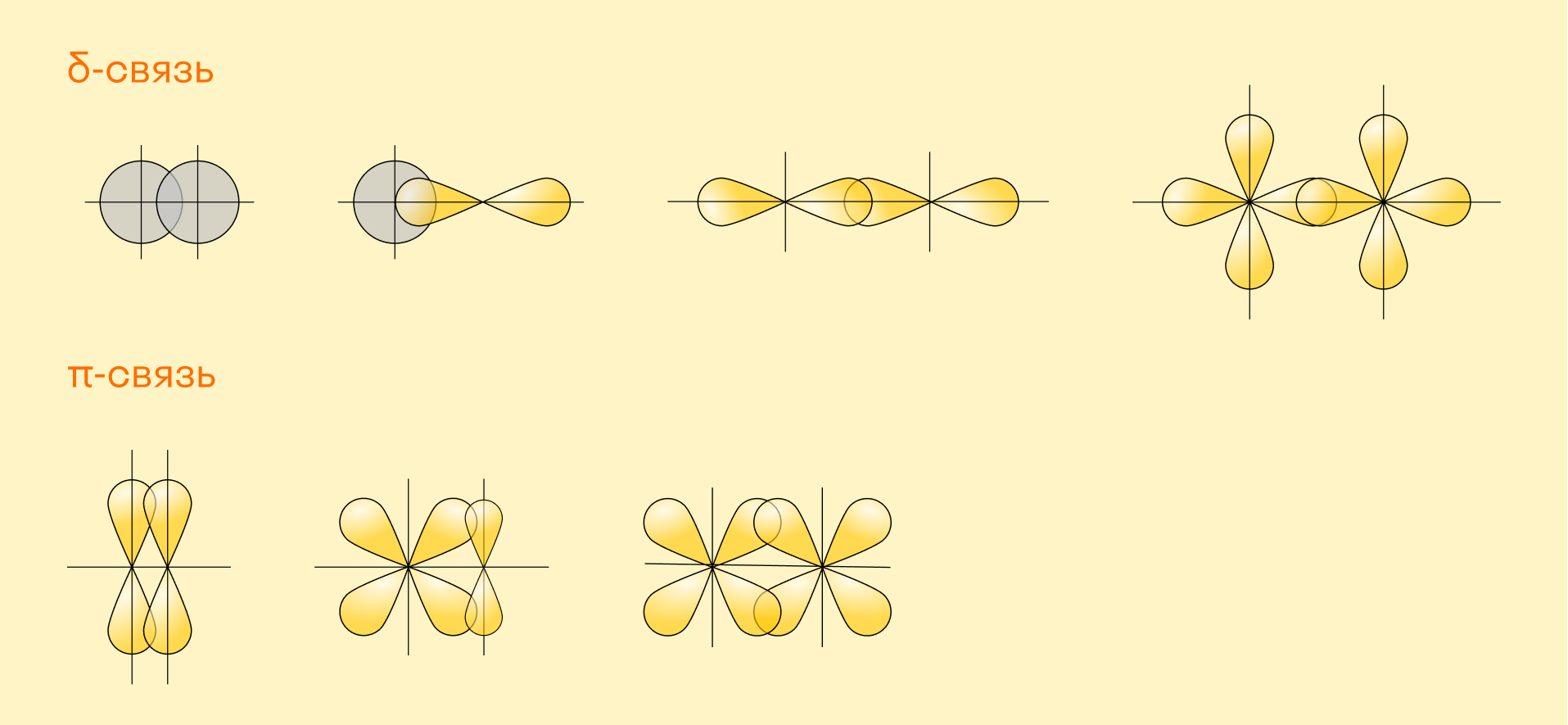
В зависимости от взаимного расположения орбиталей выделяют:
σ-связи, которые образуются, если перекрывание орбиталей идет по оси, соединяющей ядра атомов (т. е. линейно);
π-связи, которые предполагают боковое перекрывание (электронные облака находятся под углом друг к другу).
Как понятно из этих определений, два атома могут иметь только одну σ-связь, а в дополнение к этому они могут быть связаны с другими атомами π-связями.
Вопросы для самопроверки
Дайте определение ковалентной связи.
Что такое ковалентная полярная связь, чем она отличается от неполярной?
Исключите лишнее: ковалентная полярная связь характерна для H2S, O2, N2O5, SF6.





