Гидролиз в химии, его значение и формула, определение и как сделать
Ключевые слова конспекта: Гидролиз необратимый и обратимый. Гидролиз солей в зависимости от силы кислот и оснований, образующих соль. Роль гидролиза в обмене веществ. Роль гидролиза в энергетическом обмене.
Слово «гидролиз» (от др.-греч. hydor — вода и lysis — разложение) буквально означает «разложение вещества водой».
| Гидролиз — реакции обменного взаимодействия веществ с водой, приводящие к их разложению. |
Гидролиз бывает необратимым и обратимым.
Если соль образована слабым нерастворимым основанием и слабой летучей кислотой, она существует только в сухом виде, так как в воде полностью разлагается, т. е. подвергается необратимому гидролизу, например:
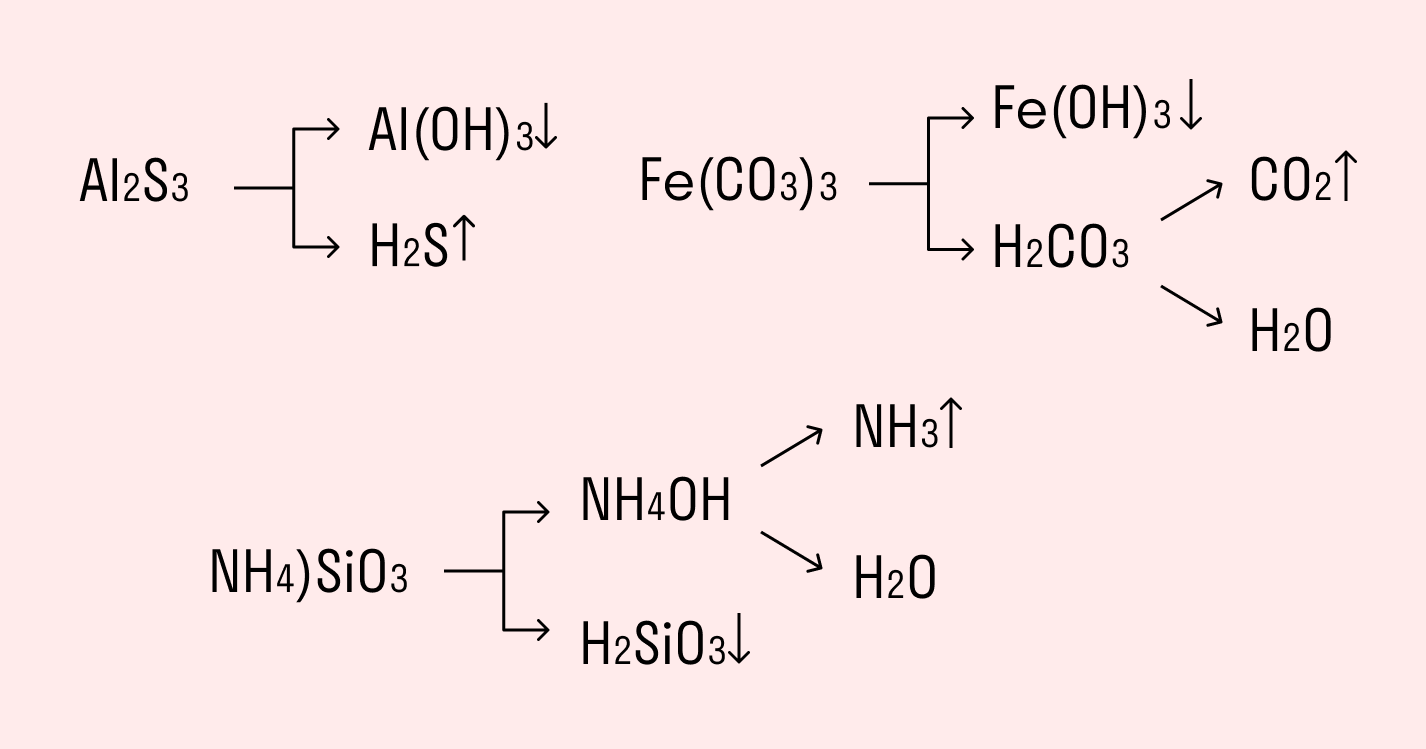
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
Кроме некоторых солей, необратимому гидролизу подвергаются многие бинарные (двухэлементные) соединения — фосфиды, нитриды, силициды, гидриды и т. д. Например:
Zn3P2 + 6Н2O = 3Zn(OH)2↓ + 2PH3↑
Эта реакция лежит в основе применения фосфида цинка в качестве зооцида, т. е. вещества, используемого для борьбы с животными-вредителями, прежде всего грызунами.
В органической химии необратимый гидролиз используется для получения ацетилена карбидным способом:
Результаты опыта, наверное, для вас неожиданны: только во второй пробирке индикаторная бумага показала нейтральную среду, тогда как в первой — щелочную, а в третьей — кислотную. Почему? Объяснить результаты эксперимента нам поможет понятие обратимый гидролиз.
Гидролиз солей происходит вследствие взаимодействия катиона металла или аниона кислотного остатка, входящих в состав соли, с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение, в водном растворе появляется избыток катионов водорода или гидроксид–анионов, обусловливающих кислотную или щелочную реакцию среды.
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, карбонат натрия Na2CO3 образован сильным основанием (щёлочью) — гидроксидом натрия NaOH и слабой угольной кислотой Н2СО3.

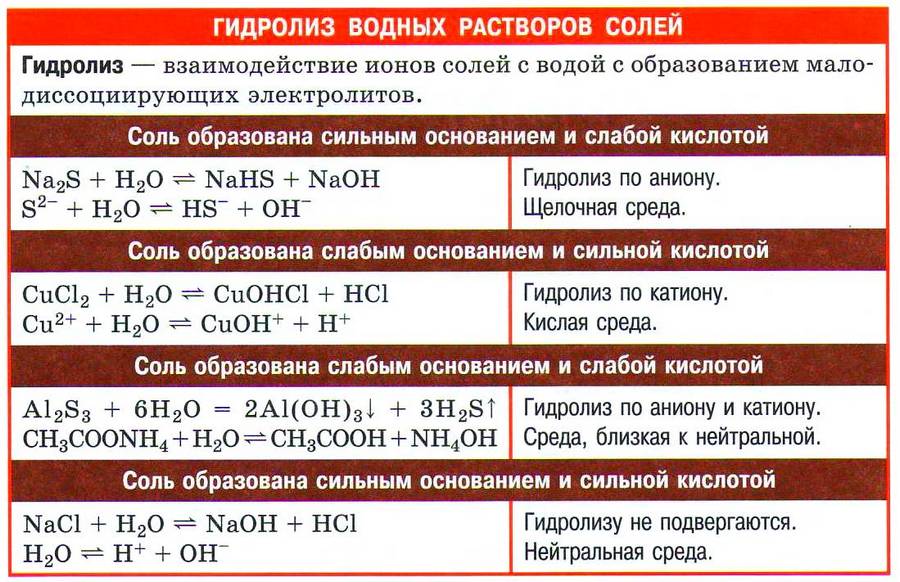
В зависимости от силы основания и кислоты как электролитов все соли можно разделить на четыре типа. Рассмотрим поведение солей различных типов в водных раствора х.

✅ 1. Соли, образованные сильным основанием и слабой кислотой, например карбонат натрия:

Карбонат натрия хорошо растворим в воде и полностью диссоциирует на ионы:

Угольная кислота — слабый электролит. Следовательно, катионы водорода прочно удерживаются карбонат–анионом и с трудом отщепляются в раствор. Верно и обратное: карбонат-анион СО3 2– легко присоединяет катион водорода Н + , отрывая его у молекулы воды. Карбонат-анион при этом превращается в гидрокарбонат, а от молекулы воды в растворе остаётся анион ОН – :
Мы записали ионное уравнение гидролиза. В результате этого процесса в растворе накапливаются гидроксид-анионы, определяющие щелочную реакцию среды. В данном случае говорят, что идёт гидролиз по аниону.

Молекулярное уравнение гидролиза карбоната натрия имеет вид

✅ 2. Соли, образованные слабым основанием и сильной кислотой. Рассмотрим пример гидролиза хлорида цинка:

В водном растворе хлорид цинка полностью диссоциирует:

Гидролизу подвергается тот ион, который принадлежит слабому электролиту, поэтому данная соль гидролизуется по катиону. Отрывая от молекулы воды гидроксид-анион, катион Zn 2+ способствует накоплению в растворе катионов водорода:

Молекулярное уравнение гидролиза легко записать, если в ионном уравнении дописать хлорид-анионы:
Реакцию среды в растворе данной соли определяет наличие катионов Н + : среда кислотная.
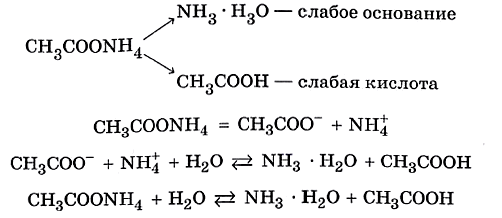
✅ 3. Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу по катиону и по аниону. Катион и анион делят между собой молекулу воды, присоединяя соответственно гидроксид–анион и катион водорода. Например, ацетат аммония:
В растворе ацетата аммония среда нейтральная, поскольку нет избытка ни катионов водорода, ни гидроксид-анионов.
Необратимо гидролизуются и по катиону, и по аниону соли слабого нерастворимого основания и слабой летучей кислоты, что было рассмотрено в начале конспекта.
✅ 4. Не гидролизуются соли, образованные сильным основанием и сильной кислотой. В водном растворе подобных солей катионы металла (щелочного или щёлочноземельного) и анионы кислотного остатка окружены гидратными оболочками, взаимодействия с молекулами воды не происходит, поскольку это не приводит к образованию слабого электролита. Реакция среды в растворе таких солей нейтральная.
Термин «гидролиз» не должен ассоциироваться только с гидролизом солей. Это понятие значительно шире, а гидролиз солей – это лишь небольшая часть химических процессов, связанных с разложением веществ водой.
Реакции разложения органических соединений водой также называются гидролизом. Эти реакции играют исключительно важную роль и в промышленности, и в биологических процессах. В курсе органической химии вы изучали гидролиз сложных эфиров, ди- и полисахаридов, белков и других органических веществ.

Существует особая отрасль деревообрабатывающей промышленности, которая так и называется — гидролизная. Малоценные отходы лесопереработки (щепа, опилки, стружки), содержащие до 50% органического полисахарида целлюлозы, нагревают при повышенном давлении в присутствии серной кислоты (в качестве катализатора). В результате происходит гидролиз целлюлозы с образованием её мономера — глюкозы:

Полученные глюкозо-содержащие сиропы сбраживают и получают гидролизный этиловый спирт:
Важное значение имеют процессы гидролиза в живой природе. Основными компонентами пищи человека являются жиры, белки и углеводы. В пищеварительном тракте они подвергаются гидролизу с образованием аминокислот, глицерина и жирных кислот, глюкозы. Из этих «строительных кирпичиков» организм синтезирует свои собственные белки, жиры и углеводы.
Основу жизненных процессов составляет не только обмен веществ, но и обмен энергии. В энергетическом обмене главную роль играет аденозинтрифосфорная кислота (АТФ). Её молекулы гидролизуются с отщеплением остатков фосфорной кислоты и высвобождением энергии (40—60 кДж/моль):
АТФ + вода —> АДФ + фосфорная кислота + энергия
Энергия расходуется на основной обмен (поддержание температуры, рост клеток, движение и др.).
В ходе обратной реакции выделяемая за счёт окисления органических веществ энергия вновь накапливается в АТФ, которая синтезируется из аденозиндифосфорной кислоты (АДФ):
АДФ + фосфорная кислота + энергия —> АТФ + вода
Следовательно, процессы гидролиза — химический фундамент процессов ассимиляции и диссимиляции, лежащих в основе жизни на Земле.
Конспект урока по химии «Гидролиз». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Гидролиз
Гидролиз (греч. hydor – вода и lysis – разрушение) – процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает “слабое” – это правило вам очень пригодится.

- NaCl – производное основания NaOH и кислоты HCl
- KNO3 – производное основания KOH и кислоты HNO3
- CuSO4 – производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 – производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 – производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие – сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт – она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 

По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты – гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае – катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.


Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора – нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда – кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.

Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.

С целью запутать в заданиях часто бывают даны синонимы. Так “среду раствора” могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.

Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 – кислой (pH
Гидролиз солей
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
тогда соотношение для константы гидролиза соли Kг будет иметь такой вид:
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Зная, константу гидролиза, можно определить pH среды:
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH — ] 2 /[MA]
Используя это выражение можно вычислить pH раствора
[OH — ] = (Kг·[MA]) 1/2 моль/л
[H + ] = 10 -14 /[OH — ] моль/л
pH = -lg[H + ]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na + + Cl —
Na + + HOH ↔ реакция практически не протекает
Cl — + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4 + + Cl —
NH4 + + HOH ↔ NH4OH + H +
Cl — + HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe 2+ + 2Cl —
| I ступень | Fe 2+ + HOH ↔ (FeOH) + + H + FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH) + + HOH ↔ Fe(OH)2 + H + (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kг намного больше Kосн, то среда сильнокислая, при Kг намного меньшей Kосн — среда слабокислая, а если Kг и Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na + + CN —
CN — + HOH ↔ HCN + OH —
Na + + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
| I ступень | SO3 2- + HOH ↔ HSO3 — + OH — Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3 — + HOH ↔ H2SO3 + OH — NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kг намного больше Kк-ты, то среда сильнощелочная, при Kг намного меньшей Kк-ты — среда слабощелочная, а если Kг и Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al 3+ + 3Cl —
Al 3+ + 3HOH ↔ Al(OH)3 + 3H +
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na + + S 2-
S 2- + 2HOH ↔ H2S + 2OH —
Суммарная реакция гидролиза:
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Гидролиз

Если вы видели, как красят ткани, то знаете: порошковый краситель растворяется в воде, а затем часть его оседает на полотне. Этот процесс называют гидролизом. Он часто встречается в природе и в быту. Более того — благодаря ему протекают некоторые жизненно важные реакции нашего организма. Разберемся, что такое гидролиз и как он проходит.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
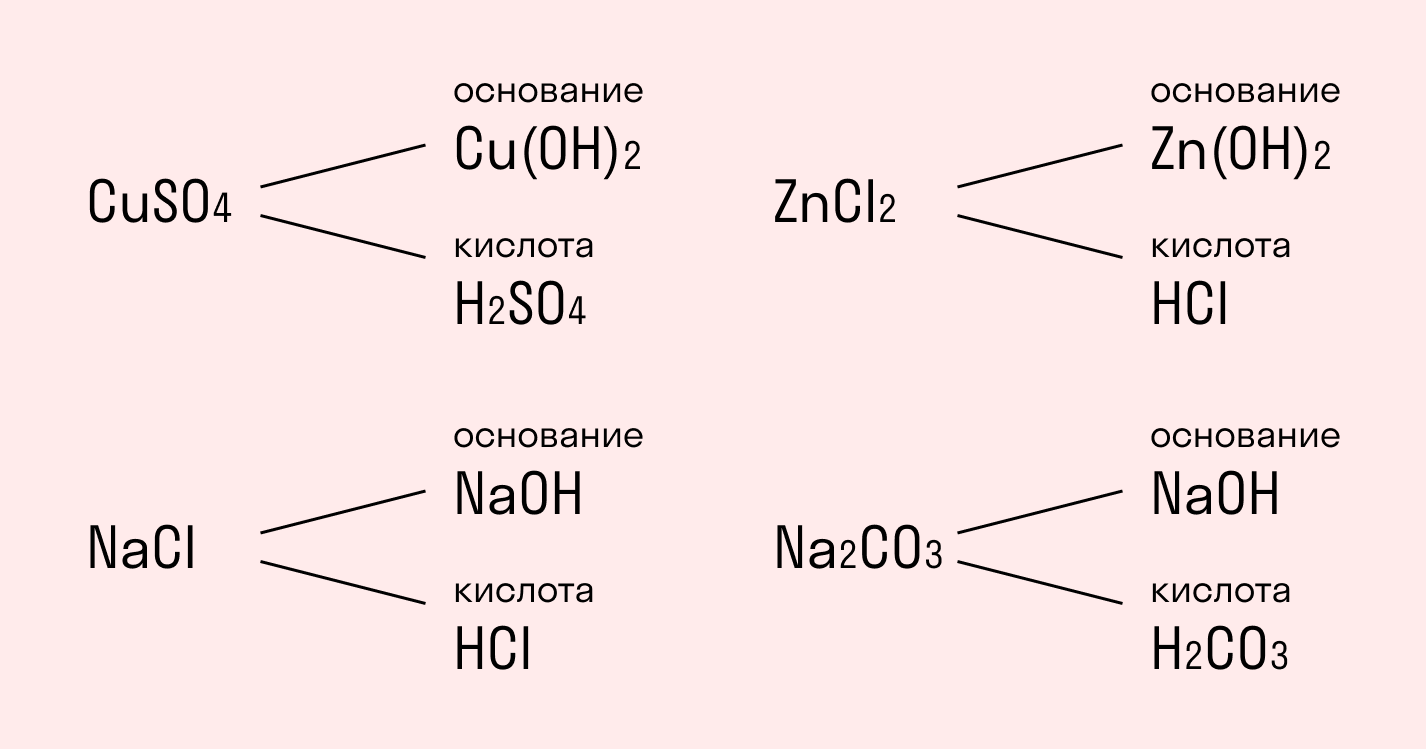
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H + или гидроксильная группа OH − .
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.

А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
В данном случае:
XY — формула соли;
XH — кислотный остаток;
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.

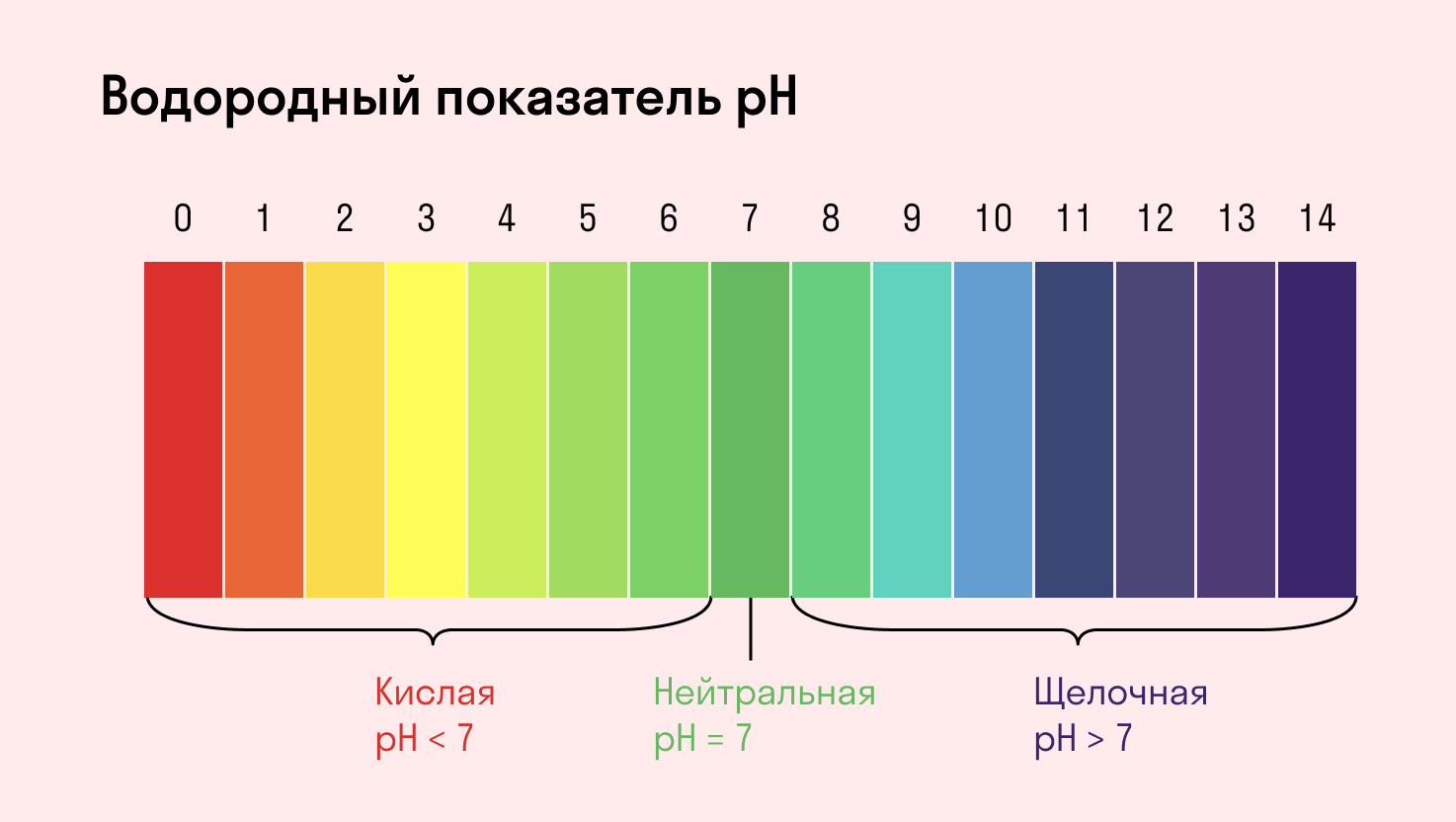
В учебном материале и в задачах вместо словосочетания «среда раствора» можно встретить «водородный показатель pH». По сути это одно и то же. В нейтральной среде pH = 7, в кислой среде с избытком положительно заряженных ионов водорода H + — pH меньше 7, а в щелочной среде с избытком отрицательно заряженных ионов OH − — pH больше 7.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH − . В итоге образуется раствор с избытком ионов водорода H + .
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4 + связывает ионы воды OH − .
Ионное уравнение: NH4 + + NO3 − + HOH ↔ NH4OH + H + + NO3 −
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H + в молекуле воды. В итоге получается раствор с повышенным содержанием OH − .
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2 − связывает ионы воды H + .
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
При взаимодействии гидрофосфатов с водой среда всегда будет щелочной. Дигидрофосфаты, гидросульфиты и гидросульфаты всегда дают кислую среду, независимо от силы основания. Например, гидросульфит натрия имеет сильное основание и слабую кислоту, исходя из чего можно было бы предположить образование щелочной среды. Но ввиду особенностей диссоциации в водном растворе pH будет меньше 7 (кислая среда).
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Определить среду водного раствора, получившегося в результате гидролиза кислых солей, бывает непросто. В данном случае кроме гидролизации одновременно идет диссоциация аниона соли, и какой будет среда — зависит от преобладания того или иного процесса. Если преобладает гидролиз — среда щелочная, если диссоциация — кислая.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.

Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Гидролиз
Гидролиз представляет собой взаимодействие вещества с водой, происходящее без изменения степеней окисления элементов, образующих данную систему.
Выделяют два вида гидролиза: гидролиз солей и гидролиз солеобразных бинарных соединений (фосфидов, сульфидов, карбидов, галогенидов некоторых металлов и неметаллов).
Рассмотрим процесс гидролиза на примере: возьмем три пробирки в которых находятся растворы следующих солей – карбоната натрия (Na2CO3 ), хлорида алюминия (AlCl3) и хлорида натрия (NaCl) одинаковой концентрации, бесцветные. Внесем в каждую из пробирок по одной капле универсального индикатора. Цвет раствора в каждой пробирке изменится. Так, в пробирке с Na2CO3 станет голубым, что свидетельствует о наличии щелочной среды (рН>7), в пробирке с AlCl3 появится розовая окраска (кислая среда, рН<7), а в пробирке с NaCl раствор станет желто-зеленого цвета (нейтральная среда, рН=7). Изменение окраски растворов связано с явлением гидролиза – соль прореагировала с водой.
Гидролиз солей
Гидролиз солей – это взаимодействие слабого компонента соли с водой, приводящее к образованию малодиссоциирующего соединения.
Рассмотрим гидролиз первой из солей – карбоната натрия:
Na2CO3 ↔ 2Na + + CO3 2- (подчеркиванием выделяем слабый компонент)
CO3 2- + HOH ↔ HCO3 — + OH — — уравнение гидролиза в ионном виде
Наличие гидроксид иона указывает на щелочной характер среды. Гидролиз – обратимый процесс.
Na2CO3 + HOH ↔ NaHCO3 + NaOH – молекулярное уравнение гидролиза (1-я ступень)
NaHCO3 + HOH ↔ CO2↑ + H2O + NaOH (2-я ступень гидролиза)
Гидролиз протекает всегда в очень незначительной степени и по первой ступени, вторая и и последующие ступени возможны теоретически.
Рассмотрим гидролиз хлорида алюминия:
Al 3+ + HOH ↔ AlOH 2+ + H + (1-я ступень гидролиза)
Наличие Н + иона свидетельствует о наличии кислой среды.
AlOH 2+ + HOH ↔ Al(OH)2 + + H + (2-я ступень гидролиза)
Al(OH)2 + + HOH ↔ Al(OH)3 ↓ + H + (3-я ступень гидролиза)
Рассмотрим гидролиз хлорида натрия:
Слабого иона нет, следовательно, гидролиз невозможен и среда будет нейтральной.
Гидролизу подвергаются соли образованные сильным основанием и слабой кислотой ( Na2SiO3, K2SO3, K2S), слабым основанием и сильной кислотой ( Zn(NO3)2, CuCl2, CuSO4).
Если соль образована слабым основанием и слабой кислотой, то гидролиз протекает и по катиону и по аниону. В этом случае заранее определить среду весьма сложно. Например:
Если соль образована сильным основанием и сильной кислотой – гидролиза не происходит.
Гидролиз солеобразных бинарных соединений
Как правило, гидролиз таких соединений протекает необратимо. Карбиды, нидриды, фосфиды, сульфиды при взаимодействии с водой образуют гидроксиды металлов и углеводороды, аммиак, фосфин, сероводород, соответственно.
Константа и степень гидролиза
При протекании гидролиза устанавливается химическое равновесие. Согласно закону действующих масс можно записать константу равновесия:
[H2O] — фактически постоянная величина, следовательно K[H2O] – также постоянная величина, которую называют константой гидролиза и обозначают [H2O].
![]()
[OH][H] = КW (ионное произведение воды)
= Kдисс (константа диссоциации кислоты), следовательно
КГ =КW (ионное произведение воды) / Kдисс (константа диссоциации слабого компонента).
Чем выше значение константы гидролиза, тем в большей степени он протекает.
h – степень гидролиза – отношение числа молекул, подвергшихся гидролизу к общему числу растворенных молекул.
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греч. hydro — вода, lysis — распад, разложение).
Гидролиз — это реакция обменного разложения вещества водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную ($рН 7$), нейтральную ($рН = 7$). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов $Н^$ или $ОН^$, и раствор соли становится кислотным или щелочным соответственно.
Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль $KClO$ образована сильным основанием $KOH$ и слабой кислотой $HClO$.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия $KCN$ образована сильным основанием $KOH$ и слабой кислотой $HCN$:
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения
2) полная диссоциация соли (сильного электролита):
Образующиеся при этих процессах ионы $Н^$ и $CN^$ взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты $HCN$, тогда как гидроксид — ион $ОН^$ остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по аниону $CN^$.
Запишем полное ионное уравнение происходящего процесса (гидролиза):
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т.к. вода — значительно более слабый электролит, чем цианистоводородная кислота $HCN$.
Уравнение показывает, что:
а) в растворе есть свободные гидроксид-ионы $ОН^$, и концентрация их больше, чем в чистой воде, поэтому раствор соли $KCN$ имеет щелочную среду ($рН > 7$);
б) в реакции с водой участвуют ионы $CN^$, в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов, которые участвуют в реакции с водой:
| $HCOO^, CH_3COO^, NO_2^$ | от слабых кислот — муравьиной $HCOOH$, уксусной $CH_3COOH$, азотистой $HNO_2$ |
| $S^, CO_3^, SO_3^, PO_4^$ | от слабых кислот — сероводородной $H_2S$, угольной $H_2CO_3$, сернистой $H_2SO_3$, ортофосфорной $H_3PO_4$ |
Рассмотрим гидролиз карбоната натрия $Na_2CO_3$.
Происходит гидролиз соли по аниону $CO_3^$.
Полное ионное уравнение гидролиза:
Сокращенное ионное уравнение гидролиза:
Продукты гидролиза — кислая соль $NaHCO_3$ и гидроксид натрия $NaOH$.
Среда водного раствора карбоната натрия — щелочная ($рН > 7$), потому что в растворе увеличивается концентрация ионов $ОН^$. Кислая соль $NaHCO_3$ тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
а) по аниону соли, как правило, гидролизуются обратимо;
б) химическое равновесие в таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солей щелочная ($рН > 7$);
г) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония $NH_4Cl$.
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
2) полная диссоциация соли (сильного электролита):
Образующиеся при этом ионы $OH^$ и $NH_4^$ взаимодействуют между собой с получением $NH_3·H_2O$ (слабый электролит), тогда как ионы $Н^$ остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т.к. вода $Н_2О$ — значительно более слабый электролит, чем гидрат аммиака $NH_3·H_2O$.
Сокращенное ионное уравнение гидролиза:
Уравнение показывает, что:
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма. Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза:
Если в крови избыток ионов $Н^$, они связываются с гидроксид-ионами $ОН^$, и равновесие смещается вправо. При избытке гидроксид-ионов $ОН^$ равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
Другой пример: в составе слюны человека есть ионы $HPO_4^$. Благодаря им в полости рта поддерживается определенная среда ($рН=7-7.5$).





