Урок №66. Валентность и степень окисления. Правила определения степеней окисления элементов
Степень окисления (СО) – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
– Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
– Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
– Оба атома имеют незавершённый внешний уровень.
– Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
F 0 + 1ē → F -1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион – анион )
Na 0 – 1ē → Na +1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион – катион )
Процесс отдачи электронов атомом, называется окислением .
Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется восстановителем .
Процесс принятия электронов атомом, называется восстановлением .
Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем .
Правила определения степени окисления атома
1. В сложных веществах степень окисления атома водорода +1 (Исключения, гидриды металлов MeH x -1 , например, NaH -1 , CaH 2 -1 , AlH 3 -1 )
2. В сложных веществах степень окисления кислорода -2 (Исключения, H 2 O 2 -1 и O +2 F 2 )
3. В сложных веществах степень окисления фтора -1
4. В сложных веществах степень окисления металлов всегда «+» , металлы только отдают электроны Ме -ne – →Me +n
5. Элементы IA, IIA, IIIA групп отдают электроны и проявляют высшую «+» степень окисления, равную номеру группы
Э -ne – →Э +n
6. Элементы IVA-VIIA групп отдают и принимают электроны и проявляют высшую «+» степень окисления, равную номеру группы и низшую «-», равную N групп -8 .
Э -ne – →Э +n
Э +ne – →Э -n
7. Элементы VIIIA группы (инертные или благородные газы) проявляют степень окисления равную
8. Степень окисления атомов в простых веществах равна
F 2 , S , O 3
9. В сложном веществе алгебраическая сумма СО всех атомов, с учётом их индексов, равна 0; а в сложном ионе его заряду.
H +1 N +5 O 3 -2 ((+1)*1)+((+5)*1)+((-2)*3)=0
(S +6 O 4 -2 ) -2 ((+6)*1)+((-2)*4)=-2
10. Металлы главных подгрупп IА-IIIА групп проявляют СО
+n = N группы
11. Металлы главных подгрупп групп IV-VII и металлы побочных подгрупп проявляют переменную степень окисления +n, согласно правилу №9 (с учётом рядом стоящего аниона – см. «Таблица растворимости веществ в воде»)
Задание 1 – определите степени окисления всех атомов в формуле серной кислоты H 2 SO 4 ?
1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Х=6 или (+6), следовательно, у серы CО +6, т.е. S +6
Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты H 3 PO 4 ?
1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Х=5 или (+5), следовательно, у фосфора CО +5, т.е. P +5
Задание 3 – определите степени окисления всех атомов в формуле иона аммония (NH 4 ) + ?
1. Проставим известную степень окисления у водорода, а СО азота примем за «х»
Степени окисления элементов. Как найти степени окисления?
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
| Элемент | Характерная степень окисления | Исключения |
| H | +1 | Гидриды металлов: LIH -1 |
| F | -1 | F 2 |
| O | -2 | F 2 O +2 ; пероксиды, надпероксиды, озониды |
| Li, Na, K, Rb, Cs, Fr | +1 |   |
| Be, Mg, Ca, Sr, Ba, Ra | +2 |   |
| Al | +3 |   |
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3 ).
Решение . Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х – искомая степень окисления. Составляем простейшее уравнение: х + 3 • (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 • (+1) + х + 4 • (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .
Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3 ) 3 .
Решение . Алгоритм остается неизменным. В состав “молекулы” нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 • (+3) + 3х + 9 • (-2) = 0. Ответ: Al +3 (N +5 O -2 3 ) 3 .
Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4 ) 3- .
Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 • (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5 . Определите степени окисления всех элементов в (NH 4 ) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота – нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую “молекулу”, а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1 ) 2 S +6 O 4 -2 .
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте “разделить” молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
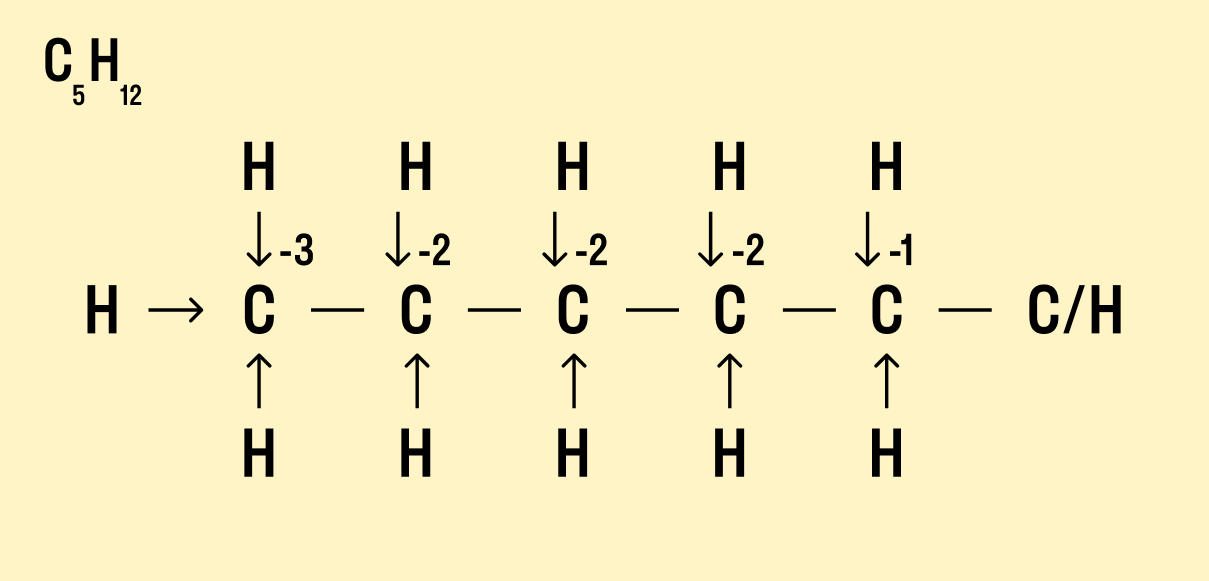
Пример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH.
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Не смешивайте понятия “валентность” и “степень окисления”!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность – нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую “экзотику” здесь обсуждать не будем);
- степень окисления – формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие “валентность”, наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему “Степень окисления”
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Как определить степень окисления
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 13 человек(а).
Количество просмотров этой статьи: 624 843.
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления — это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.

- Например, Al(s) и Cl2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
- Обратите внимание, что аллотропная форма серы S8, или октасера, несмотря на свое нетипичное строение, также характеризуется нулевой степенью окисления.

- Например, степень окисления иона Cl – равняется -1.
- Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и таким образом степень его окисления равна -1.

- В качестве примера рассмотрим соединение, содержащее ион алюминия. Общий заряд соединения AlCl3 равен нулю. Поскольку нам известно, что ионы Cl – имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.

- Если кислород находится в элементарном состоянии (O2), его степень окисления равна 0, как и в случае других элементарных веществ.
- Если кислород входит в состав перекиси, его степень окисления равна -1. Перекиси — это группа соединений, содержащих простую кислород-кислородную связь (то есть анион перекиси O2 -2 ). К примеру, в составе молекулы H2O2 (перекись водорода) кислород имеет заряд и степень окисления -1.
- В соединении с фтором кислород обладает степенью окисления +2, читайте правило для фтора ниже.

- Например, в H2O степень окисления водорода равна +1, поскольку атом кислорода имеет заряд -2, и для общей нейтральности необходимы два заряда +1. Тем не менее, в составе гидрида натрия степень окисления водорода уже -1, так как ион Na несет заряд +1, и для общей электронейтральности заряд атома водорода (а тем самым и его степень окисления) должен равняться -1.

Фтор всегда имеет степень окисления -1. Как уже было отмечено, степень окисления некоторых элементов (ионы металлов, атомы кислорода в перекисях и так далее) может меняться в зависимости от ряда факторов. Степень окисления фтора, однако, неизменно составляет -1. Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность — иначе говоря, атомы фтора наименее охотно расстаются с собственными электронами и наиболее активно притягивают чужие электроны. Таким образом, их заряд остается неизменным.
Что такое степень окисления, как определять и расставлять
В школе химия до сих пор занимает место одного из самых сложных предметов, который, ввиду того, что скрывает множество затруднений, вызывает у учеников (обычно это в период с 8 по 9 классы) больше ненависти и безразличия к изучению, чем интереса. Всё это снижает качество и количество знаний по предмету, хотя во многих сферах по сей день требуются специалисты в этой области. Да, сложных моментов и непонятных правил в химии иногда даже больше, чем кажется. Один из вопросов, которые волнуют большинство учеников, это что такое степень окисления и как определять степени окисления элементов.
Важное правило — правило расстановки, алгоритмы
Здесь много говорится о таких соединениях, как оксиды. Для начала, любой ученик должен выучить определение оксидов — это сложные соединения из двух элементов, в их составе находится кислород. К классу бинарных соединений оксиды относят по той причине, что в алгоритме кислород стоит вторым по очереди. При определении показателя важно знать правила расстановки и рассчитать алгоритм.
Это интересно: полярная и неполярная ковалентная связь — что это?
Алгоритмы для кислотных оксидов
Степени окисления — это численные выражения валентности элементов. К примеру, кислотные оксиды образованы по определённому алгоритму: сначала идут неметаллы или металлы (их валентность обычно от 4 до 7), а после идёт кислород, как и должно быть, вторым по порядку, его валентность равняется двум. Определяется она легко — по периодической таблице химических элементов Менделеева. Также важно знать то, что степень окисления элементов — это показатель, который предполагает либо положительное, либо отрицательное число.
В начале алгоритма, как правило, неметалл, и его степень окисления — положительная. Неметалл кислород в оксидных соединениях имеет стабильное значение, которое равняется -2. Чтобы определить верность расстановки всех значений, нужно умножить все имеющиеся цифры на индексы у одного конкретного элемента, если произведение с учётом всех минусов и плюсов равняется 0, то расстановка достоверна.
Расстановка в кислотах, содержащих кислород

Кислоты являются сложными веществами, они связаны с каким-либо кислотным остатком и содержат в себе один или несколько атомов водорода. Здесь, для вычисления степени, требуются навыки в математике, так как показатели, необходимые для вычисления, цифровые. У водорода или протона он всегда одинаков — +1. У отрицательного иона кислорода отрицательная степень окисления -2.
После проведения всех этих действий можно определить степень окисления и центрального элемента формулы. Выражение для её вычисления представляет собой формулу в виде уравнения. Например, для серной кислоты уравнение будет с одним неизвестным.
Основные термины в ОВР
ОВР — это восстановительно-окислительные реакции.
- Степень окисления любого атома — характеризует способность этого атома присоединять или отдавать другим атомам электроны ионов (или атомов);
- Принято считать окислителями либо заряженные атомы, либо незаряженные ионы;
- Восстановителем в этом случае будут заряженные ионы или же, напротив, незаряженные атомы, которые теряют свои электроны в процессе химического взаимодействия;
- Окисление заключается в отдаче электронов.
Как расставлять степень окисления в солях
Соли состоят из одного металла и одного или нескольких кислотных остатков. Методика определения такая же, как и в кислотосодержащих кислотах.
Металл, который непосредственно образует соль, располагается в главной подгруппе, его степень будет равна номеру его группы, то есть всегда будет оставаться стабильным, положительным показателем.
В качестве примера можно рассмотреть расстановку степеней окисления в нитрате натрия. Соль образуется с помощью элемента главной подгруппы 1 группы, соответственно, степень окисления будет являться положительной и равна единице. В нитратах кислород имеет одного значение — -2. Для того чтобы получить численное значение, для начала составляется уравнение с одним неизвестным, учитывая все минусы и плюсы у значений: +1+Х-6=0. Решив уравнение, можно прийти к тому факту, что численный показатель положителен и равен + 5. Это показатель азота. Важный ключ чтобы высчитать степень окисления — таблица.
Степень окисления элемента

В химии степень окисления элементов говорит о том, как проходят окислительно-восстановительные реакции, а точнее — как при этом атомы перераспределяют между собой электроны. Это не очень сложная тема, но в ней часто бывает путаница. Разберемся, как считать степень окисления в разных соединениях.
О чем эта статья:
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
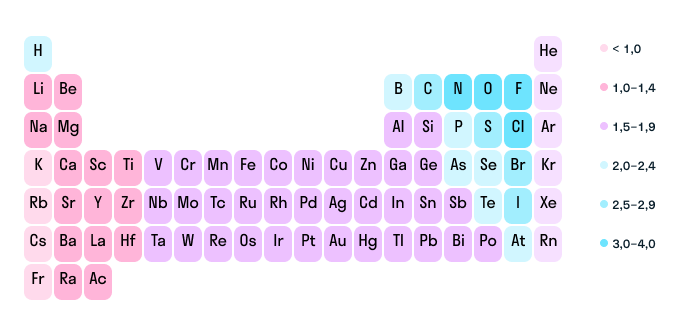
Шкала относительной электроотрицательности
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.

Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Степень окисления Cl2, S8 равна 0.
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 +1 S -6 O4 -2 .
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 + и SO4 2- .
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Получаем следующие окислительные числа: (N -3 H4 +1 )2S +6 O4 -2 .
Как определить высшую и низшую степень окисления
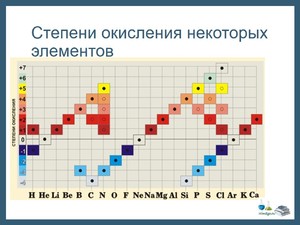
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Заряд углерода равен −2, т. е. C -2 H4 +1 O -2 .
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
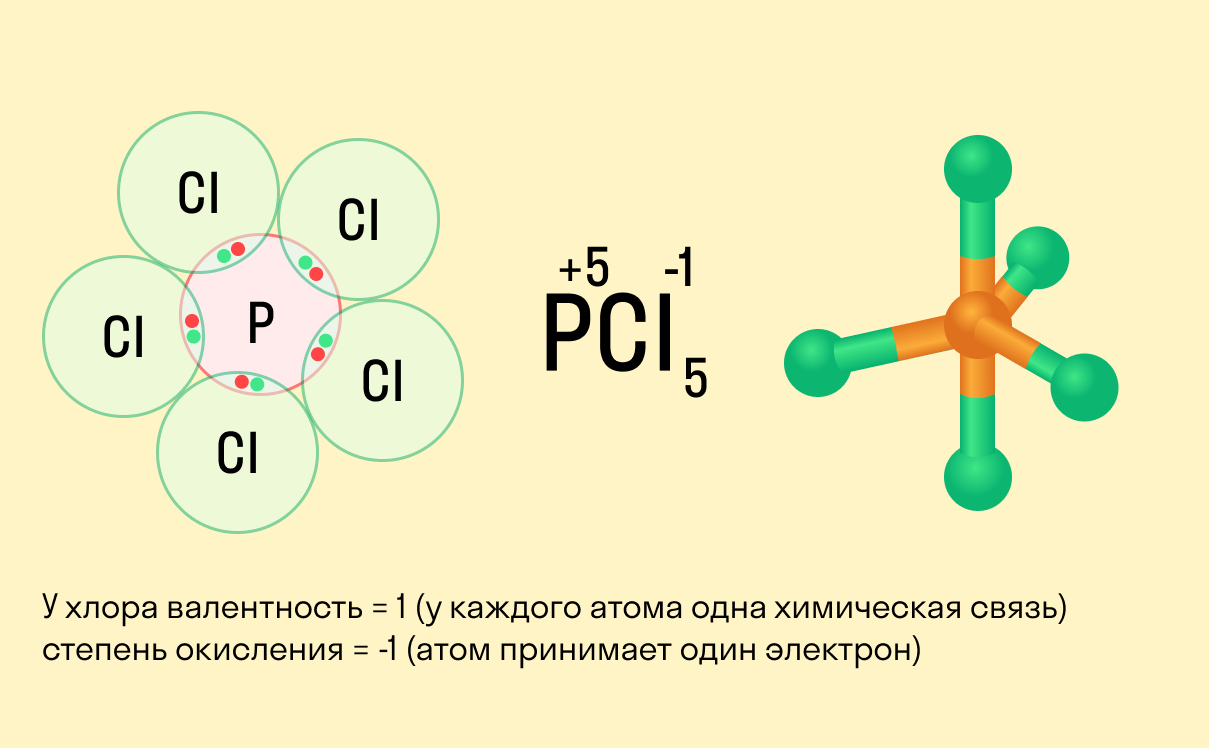
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Правила определения степени окисления
При определении степени окисления элемента, следует руководствоваться следующими положениями:
1. Степень окисления атомов элементарных металлов равна нулю (Na, Сa, Al и т.д.).
2. Степень окисления атомов неметаллов в молекулах простых веществ равна нулю (N2, Cl2, O2, H2 и т.д.).
3. Во всех соединениях щелочные металлы имеют степень окисления (+1), щелочноземельные (+2).
4. Водород в соединениях с неметаллами имеет степень окисления (+1), а в солеобразных гидридах (NаН, СаН2 и т.д.) (–1).
5. Фтор — наиболее электроотрицательный элемент, в соединениях с другими элементами имеет степень окисления (–1).
6. Кислород в соединениях проявляет степень окисления (–2). Исключение составляют OF2, в котором степень окисления кислорода (+2), и пероксиды, например, H2O2 , Na2O2 , в которых степень окисления кислорода (–1).
7. Степень окисления может быть не только целым, но и дробным числом. Так, в KO2 и KO3 для кислорода она соответственно равна (–1/2) и (–1/3).
8. В нейтральных молекулах алгебраическая сумма всех степеней окисления равна нулю.
9. Алгебраическая сумма степеней окисления всех атомов, входящих в ион, равна заряду иона.
Пример 1.
Найти степень окисления хрома в молекуле K2Cr2О7.
Составим для этой молекулы уравнение:
(+1)×2 + x×2 + (–2)×7 = 0,
где (+1) — степень окисления калия; 2 — число атомов калия; x — степень окисления хрома; 2 — число атомов хрома; (–2) — степень окисления кислорода; 7 — число атомов кислорода.
Решая уравнение, получаем x = +6.
Пример 2.
Определить степень окисления хлора в ионе СlО4 – .
Составим для данного иона уравнение:
x×1+ (–2)×4 = –1,
где x — степень окисления хлора; (–2) — степень окисления кислорода; 4 — число атомов кислорода; (–1) — заряд всего иона.
Решая уравнение, получаем x = +7.
1.4. Важнейшие восстановители иокислители
Величина степени окисления атома элемента в составе соединения дает информацию о том, в каком процессе этот атом может участвовать.
Атомы, имеющие в соединении низшую степень окисления, могут выступать только в роли восстановителя. Они способны только отдавать электроны и окисляться, проявляя восстановительные свойства, например:
N –3 , P –3 , Cl –1 , O –2 , S –2 , I –1 , F –1 и т.п.
Атомы в соединениях, имеющие высшую степень окисления, являются только окислителями. Они могут только принимать электроны и восстанавливаться, проявляя при этом окислительные свойства, например:
N +5 , Cr +6 , Zn +2 , Cl +7 , P +5 и т.п.
Атомы, проявляющие в соединениях промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства. Это зависит от того, реагируют ли они с более сильными окислителями или с более сильными восстановителями, например:
Mn +6 , Fe +2 , Sn +2 , S +4 , N +3 и т.п.
Например, четырехвалентная сера может быть как восстановителем:
S +4 – 2ē→ S +6 (окисление),
так и окислителем:
S +4 + 4ē→ S 0 (восстановление).
Такое свойство называется окислительно-восстановительной двойственностью.
Если говорить об окислительно-восстановительных свойствах эламентов в виде простых веществ, то они согласуются с величиной электроотрицательности данного элемента. Восстановителями обычно являются элементарные вещества, характеризующиеся наименьшими значениями энергии ионизации. К ним относятся металлы, водород. Окислителями обычно являются элементарные вещества, характеризующиеся наибольшим сродством к электрону: F2, O2. Атомы элементарных веществ, характеризующиеся средними значениями электроотрицательности, обладают и окислительными, и восстановительными свойствами, например:
1.5. Изменение окислительно-восстановительных свойств
простых веществ по периодам и группам
Соотношение окислительных и восстановительных свойств простого (элементарного) вещества определяется числом электронов на последнем энергетическом уровне атома. В Периодической системе элементов в пределах периода с повышением порядкового номера элемента, т.е. при движении слева направо, восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, например, в третьем периоде Na — самый активный в периоде восстановитель, а хлор — самый активный в периоде окислитель. Это обусловлено увеличением количества электронов на последнем уровне, сопровождающимся уменьшением радиуса атома и приближением строения последнего уровня к устойчивому восьмиэлектронному состоянию. Металлы имеют небольшое число электронов на последнем уровне, поэтому они никогда не принимают “чужие” электроны и могут только отдавать свои. Напротив, неметаллы (кроме фтора) могут не только принимать, но и отдавать электроны, проявляя как восстановительные, так и окислительные свойства. Фтор проявляет только окислительные свойства, так как обладает наибольшей относительной электроотрицательностью из всех элементов. Таким образом, лучшие восстановители — щелочные металлы, а лучшие окислители — элементы главных подгрупп седьмой (галогены) и шестой групп.
В пределах группы изменение окислительно-восстановительных свойств обусловлено увеличением радиуса атома, что приводит к меньшему удерживанию электронов последнего энергетического уровня. У элементов как главных, так и побочных подгрупп с повышением порядкового номера (т.е. при движении сверху вниз) усиливаются восстановительные свойства и ослабевают окислительные. Поэтому из щелочных металлов наиболее активные восстановители — Сs и Fr, а наиболее активный окислитель из галогенов — фтор.
Элементы побочных подгрупп (они размещаются в четных рядах больших периодов) являются d-элементами и имеют на внешнем энергетическом уровне атомов 1-2 электрона. Поэтому эти элементы являются металлами и в состоянии простого вещества могут быть только восстановителями.





